
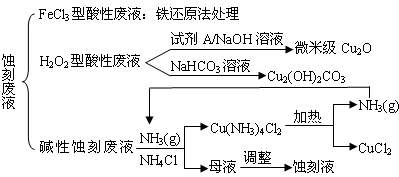
(18分)近年來,我國的電子工業(yè)迅速發(fā)展,造成了大量的電路板蝕刻廢液的產(chǎn)生和排放。蝕刻液主要有酸性的(HCl—H2O2)、堿性的(NH3—NH4Cl)以及傳統(tǒng)的(HCl—FeCl3)等3種。蝕刻廢液中含有大量的Cu2+,廢液的回收利用可減少銅資源的流失。幾種蝕刻廢液的常用處理方法如下:
⑴ FeCl3型酸性廢液用還原法處理是利用Fe和Cl2分別作為還原劑和氧化劑,可回收銅并使蝕刻液再生。發(fā)生的主要化學(xué)反應(yīng)有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,還
有 ▲ 、 ▲ 。(用離子方程式表示)。
⑵ HCl—H2O2型蝕刻液蝕刻過程中發(fā)生的化學(xué)反應(yīng)用化學(xué)方程式可表示為:
▲ 。
⑶ H2O2型酸性廢液處理回收微米級Cu2O過程中,加入的試劑A的最佳選擇是下列中的 ▲ (填序號)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 處理H2O2型酸性廢液回收Cu2(OH)2CO3的過程中需控制反應(yīng)的溫度,當(dāng)溫度高于80℃時,產(chǎn)品顏色發(fā)暗,其原因可能是 ▲ 。
⑸ 堿性蝕刻液發(fā)生的化學(xué)反應(yīng)是:2Cu+4NH4Cl+4NH3·H2O+O2= 2Cu(NH3)4Cl2+6H2O,處理堿性蝕刻廢液過程中加入NH4Cl固體并通入NH3的目的是 ▲ 。

| 年級 | 高中課程 | 年級 | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
(12分)近年來,我國的電子工業(yè)迅速發(fā)展,造成了大量的電路板蝕刻廢液的產(chǎn)生和排放。蝕刻液主要有酸性的(HCl—H2O2)、堿性的(NH3—NH4Cl)以及傳統(tǒng)的(HCl—FeCl3)等3種。蝕刻廢液中含有大量的Cu2+,廢液的回收利用可減少銅資源的流失。幾種蝕刻廢液的常用處理方法如下:
⑴ FeCl3型酸性廢液用還原法處理是利用Fe和Cl2分別作為還原劑和氧化劑,可回收銅并使蝕刻液再生。發(fā)生的主要化學(xué)反應(yīng)有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,還
有 、 。(用離子方程式表示)。
⑵ HCl—H2O2型蝕刻液蝕刻過程中發(fā)生的化學(xué)反應(yīng)用化學(xué)方程式可表示為:
。
⑶ H2O2型酸性廢液處理回收微米級Cu2O過程中,加入的試劑A的最佳選擇是下列中的 (填序號)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 處理H2O2型酸性廢液回收Cu2(OH)2CO3的過程中需控制反應(yīng)的溫度,當(dāng)溫度高于80℃時,產(chǎn)品顏色發(fā)暗,其原因可能是 。
⑸ 堿性蝕刻液在蝕刻過程中發(fā)生的化學(xué)反應(yīng)是:2Cu+4NH4Cl+4NH3·H2O+O2= 2Cu(NH3)4Cl2+6H2O,處理堿性蝕刻廢液過程中加入NH4Cl固體并通入NH3的目的是 。
查看答案和解析>>
科目:高中化學(xué) 來源:2012屆江蘇省淮州中學(xué)高三上學(xué)期10月份月考化學(xué)試卷 題型:實(shí)驗題
(18分)近年來,我國的電子工業(yè)迅速發(fā)展,造成了大量的電路板蝕刻廢液的產(chǎn)生和排放。蝕刻液主要有酸性的(HCl—H2O2)、堿性的(NH3—NH4Cl)以及傳統(tǒng)的(HCl—FeCl3)等3種。蝕刻廢液中含有大量的Cu2+,廢液的回收利用可減少銅資源的流失。幾種蝕刻廢液的常用處理方法如下:
⑴ FeCl3型酸性廢液用還原法處理是利用Fe和Cl2分別作為還原劑和氧化劑,可回收銅并使蝕刻液再生。發(fā)生的主要化學(xué)反應(yīng)有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,還
有 ▲ 、 ▲ 。(用離子方程式表示)。
⑵ HCl—H2O2型蝕刻液蝕刻過程中發(fā)生的化學(xué)反應(yīng)用化學(xué)方程式可表示為:
▲ 。
⑶ H2O2型酸性廢液處理回收微米級Cu2O過程中,加入的試劑A的最佳選擇是下列中的 ▲ (填序號)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 處理H2O2型酸性廢液回收Cu2(OH)2CO3的過程中需控制反應(yīng)的溫度,當(dāng)溫度高于80℃時,產(chǎn)品顏色發(fā)暗,其原因可能是 ▲ 。
⑸ 堿性蝕刻液發(fā)生的化學(xué)反應(yīng)是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,處理堿性蝕刻廢液過程中加入NH4Cl固體并通入NH3的目的是 ▲ 。
查看答案和解析>>
科目:高中化學(xué) 來源:2011-2012學(xué)年浙江省高三上學(xué)期期中考試化學(xué)試卷 題型:填空題
(12分)近年來,我國的電子工業(yè)迅速發(fā)展,造成了大量的電路板蝕刻廢液的產(chǎn)生和排放。蝕刻液主要有酸性的(HCl—H2O2)、堿性的(NH3—NH4Cl)以及傳統(tǒng)的(HCl—FeCl3)等3種。蝕刻廢液中含有大量的Cu2+,廢液的回收利用可減少銅資源的流失。幾種蝕刻廢液的常用處理方法如下:

⑴ FeCl3型酸性廢液用還原法處理是利用Fe和Cl2分別作為還原劑和氧化劑,可回收銅并使蝕刻液再生。發(fā)生的主要化學(xué)反應(yīng)有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,還
有 、 。(用離子方程式表示)。
⑵ HCl—H2O2型蝕刻液蝕刻過程中發(fā)生的化學(xué)反應(yīng)用化學(xué)方程式可表示為:
。
⑶ H2O2型酸性廢液處理回收微米級Cu2O過程中,加入的試劑A的最佳選擇是下列中的 (填序號)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 處理H2O2型酸性廢液回收Cu2(OH)2CO3的過程中需控制反應(yīng)的溫度,當(dāng)溫度高于80℃時,產(chǎn)品顏色發(fā)暗,其原因可能是 。
⑸ 堿性蝕刻液在蝕刻過程中發(fā)生的化學(xué)反應(yīng)是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,處理堿性蝕刻廢液過程中加入NH4Cl固體并通入NH3的目的是 。
查看答案和解析>>
科目:高中化學(xué) 來源:2011-2012學(xué)年江蘇省高三上學(xué)期10月份月考化學(xué)試卷 題型:實(shí)驗題
(18分)近年來,我國的電子工業(yè)迅速發(fā)展,造成了大量的電路板蝕刻廢液的產(chǎn)生和排放。蝕刻液主要有酸性的(HCl—H2O2)、堿性的(NH3—NH4Cl)以及傳統(tǒng)的(HCl—FeCl3)等3種。蝕刻廢液中含有大量的Cu2+,廢液的回收利用可減少銅資源的流失。幾種蝕刻廢液的常用處理方法如下:
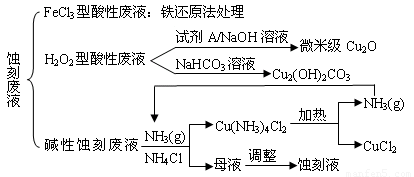
⑴ FeCl3型酸性廢液用還原法處理是利用Fe和Cl2分別作為還原劑和氧化劑,可回收銅并使蝕刻液再生。發(fā)生的主要化學(xué)反應(yīng)有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,還
有 ▲ 、 ▲ 。(用離子方程式表示)。
⑵ HCl—H2O2型蝕刻液蝕刻過程中發(fā)生的化學(xué)反應(yīng)用化學(xué)方程式可表示為:
▲ 。
⑶ H2O2型酸性廢液處理回收微米級Cu2O過程中,加入的試劑A的最佳選擇是下列中的 ▲ (填序號)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 處理H2O2型酸性廢液回收Cu2(OH)2CO3的過程中需控制反應(yīng)的溫度,當(dāng)溫度高于80℃時,產(chǎn)品顏色發(fā)暗,其原因可能是 ▲ 。
⑸ 堿性蝕刻液發(fā)生的化學(xué)反應(yīng)是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,處理堿性蝕刻廢液過程中加入NH4Cl固體并通入NH3的目的是 ▲ 。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com