
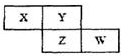
 X、Y、Z、W四種短周期元素在周期表中的位置關系如圖:若Z元素原子的最外層電子數是電子層數的2倍
X、Y、Z、W四種短周期元素在周期表中的位置關系如圖:若Z元素原子的最外層電子數是電子層數的2倍 ,故答案為:
,故答案為: ;
;
| ||
| ||


科目:高中化學 來源: 題型:
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、金屬元素的單質與非金屬元素的單質化合 |
| B、只限于ⅦA和ⅠA的元素之間 |
| C、活潑的金屬元素與活潑的非金屬元素相互化合 |
| D、任意兩種元素化合均可形成離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、電子的運動與行星相似,圍繞原子核在固定的軌道上高速旋轉 |
| B、能量低的電子只能在s軌道上運動,能量高的電子總是在f軌道上運動 |
| C、能層序數越大,s原子軌道的半徑越大 |
| D、在同一能級上運動的電子,其運動狀態肯定不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、mNA | ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、4molFe 在5molCl2中點燃反應:5Cl2+4Fe═2FeCl2+2FeCl3 |
| B、氯化鐵溶液中通入硫化氫:2Fe3++H2S═2Fe2++S↓+2H+ |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| D、NaHCO3溶液中加入過量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:
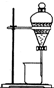 某同學為了驗證海帶中含有碘元素并提取碘單質,擬進行如下實驗,請回答相關問題.
某同學為了驗證海帶中含有碘元素并提取碘單質,擬進行如下實驗,請回答相關問題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com