
| A. | ①②③ | B. | ①⑤⑥ | C. | ①②④ | D. | ③⑤⑥ |
分析 根據價層電子對互斥理論確定中心原子雜化類型,價層電子對個數=σ鍵個數+孤電子對個數,σ鍵個數=配原子個數,孤電子對個數=$\frac{1}{2}$×(a-xb),a指中心原子價電子個數,x指配原子個數,b指配原子形成穩定結構需要的電子個數.可用sp3雜化軌道來解釋說明中心原子含有4個價層電子對,孤對電子對成鍵電子的排斥作用較強,鍵角減小,據此分析判斷.
解答 解:①CH4中碳原子價層電子對個數=4+$\frac{4-4}{2}$=4,為sp3雜化,不含孤電子對,所以空間構型是正四面體形,其鍵角為109°28′,可用sp3雜化軌道來解釋,故①選;
②NH3分子中價層電子對個數=3+$\frac{1}{2}$(5-3×1)=4,中心原子雜化類型分別為sp3,中心原子含有1個孤電子對,空間構型為三角錐,孤對電子對成鍵電子的排斥作用較強,鍵角減小,其鍵角為107°,故②選;
③H2O中心原子O原子成2個σ鍵、含有$\frac{6-1×2}{2}$=2對孤對電子,價層電子對個數=σ鍵個數+孤電子對個數=2+2=4,雜化軌道數為4,采取sp3雜化,H2O分子的立體構型是V形,其鍵角為104.5°,故③選;
④CH≡CH分子中每個碳原子形成1個C-H,1個C≡C三鍵,碳原子價層電子對個數=2+$\frac{1}{2}$(4-4×1)=2,每個碳原子雜化軌道數為2,所以采取sp雜化,其分子的立體構型是直線形,其鍵角為180°,故④不選;
⑤苯分子中碳原子價層電子對個數=3+$\frac{1}{2}$(4-4×1)=3,雜化軌道數為3,所以采取sp2雜化,其分子的立體構型是平面正六邊形,其碳碳鍵角為120°,故⑤不選;
⑥CH2═CH2 分子中碳原子價層電子對個數=3+$\frac{1}{2}$(4-4×1)=3,每個碳原子雜化軌道數為3,所以采取sp2雜化,其分子的立體構型是平面形,其碳氫鍵與碳碳鍵夾角約為120°,故⑥不選;
故選A.
點評 本題考查了原子雜化類型的判斷,根據價層電子對互斥理論來分析解答,注意孤電子對個數=$\frac{1}{2}$(a-xb)中各個字母的含義,題目難度中等.


 小學課時作業全通練案系列答案
小學課時作業全通練案系列答案 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 屬于放熱反應 | B. | 屬于氧化還原反應 | ||
| C. | 屬于復分解反應 | D. | 屬于離子反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol任何氣體的摩爾體積都約是22.4L | |
| B. | 標準狀況時,體積均為22.4 L的O2與CO2含有相同的分子數 | |
| C. | 處于標準狀況的兩種氣體,當體積均為22.4L時的質量完全相同 | |
| D. | 標準狀況時,2mol任何物質的體積均約為44.8L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | MnO4-.>Cl2>Fe3+>Cu2+>Fe2+ | B. | Fe3+>MnO4->Cl2>Cu2+>Fe2+ | ||
| C. | Cl2>MnO4->Fe3+>Cu2+>Fe2+ | D. | Cu2+>Cl2>MnO4->Fe3+>Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
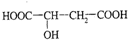 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com