
| 甲 | 乙 | |||
| 起始濃度 | 5min時濃度 | 起始濃度 | 5min時濃度 | |
| c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
| c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
| A. | x=y=0.16 | |
| B. | 反應開始時,乙中反應速率比甲快 | |
| C. | 甲中0~5min的平均反應速率:v(CO)=0.004 mol/(L•min) | |
| D. | 平衡時,乙中H2O的轉化率是50%,c(CO)是甲中的2倍 |
分析 對于CO(g)+H2O(g)?CO2(g)+H2(g),反應前后氣體的體積相等,則增大壓強,平衡不發生移動,平衡常數K=1,結合轉化率可以此計算平衡時各物質的濃度,以此解答該題,注意5min時不一定為平衡狀態.
解答 解:A.甲中起始c(CO)、c(H2O)為0.1mol/L,5min時c(CO)、c(H2O)為0.08mol/L,則CO2、H2的濃度分別為0.02mol/L,$\frac{0.02×0.02}{0.08×0.08}$<1,沒有達到平衡狀態,則不能與乙比較濃度關系,故A錯誤;
B.乙中濃度較大,則反應速率較大,故B正確;
C.甲中0~5min的平均反應速率:v(CO)=$\frac{0.02mol/L}{5min}$=0.004 mol/(L•min),故C正確;
D.平衡常數K=1,則平衡時c(CO)、c(H2O)與CO2、H2的濃度相等,因起始為1mol/L,則轉化率為50%,因壓強對平衡移動無影響,乙為甲的2倍,則c(CO)是甲中的2倍,故D正確.
故選A.
點評 本題考查化學平衡的計算,為高頻考點,側重于學生的分析能力和計算能力的考查,注意把握反應的特點,特別是壓強對平衡無影響的特點,為解答該題的關鍵,同時注意平衡常數的意義,難度中等.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源:2016-2017學年寧夏衛一高一上10月月考化學a卷(解析版) 題型:實驗題
選擇下列實驗方法分離物質,將分離方法的序號填在橫線上。
A 萃取分液 B 升華 C 結晶 D 分液 E 蒸餾 F過濾
①_____分離飽和食鹽水與沙子的混合物。
②_____從硝酸鉀和氯化鈉的混合液中獲得硝酸鉀。
③______分離水和汽油的混合物。
④_____分離CCl4(沸點為76.75℃)和甲苯(沸點為110.6℃)
⑤______分離出混在沙土中的碘單質。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽師大附中高二上10月月考化學卷(解析版) 題型:選擇題
已知分解1 mol H2O2 放出熱量98KJ,在含少量I-的溶液中,H2O2的分解機理為:H2O2+I-→H2O +IO- 慢;H2O2+IO-→H2O+O2+I- 快,下列有關反應的說法正確的是
A.反應的速率與I-的濃度有關 B. IO-也是該反應的催化劑
C.反應活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
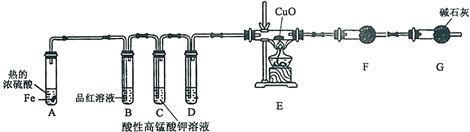
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
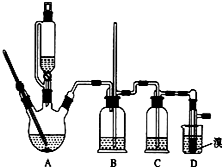 實驗室制備1,2-二溴乙烷的反應原理如下:
實驗室制備1,2-二溴乙烷的反應原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
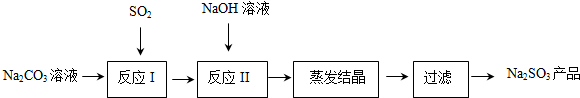
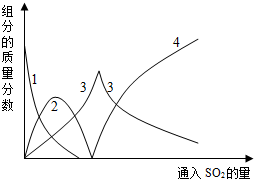
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
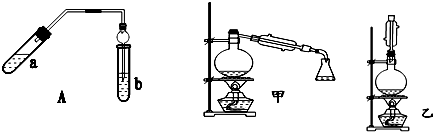
| 實驗編號 | 試管a中試劑 | 試管b中試劑 | 測得有機層的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1 濃硫酸 | 飽和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
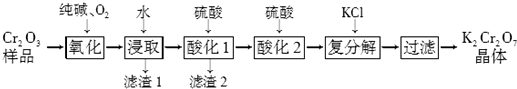
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com