
分析 (1)兩個反應靠O2聯系起來,只要知道O2和另外任意一種氣體的平衡濃度,均可求出混合氣體的平衡組成;
(2)由方程式 2CO(g)+O2(g)?2CO2(g),計算平衡時反應消耗的n(O2),進而計算反應2H2O(g)?2H2(g)+O2(g)中生成O2、消耗的水的物質的量,所以n(H2O)平=n(H2O)起始-n(H2O)消耗.
解答 解:(1)由兩個方程式可知,兩個反應靠O2聯系起來,只要知道O2和另外任意一種氣體的平衡濃度,均可求出混合氣體的平衡組成,當知道H2O和H2或CO和CO2的平衡濃度時,由于兩個方程式無法通過O2建立反應量的關系,所以無法求其混合氣體的平衡組成,因而不能是這兩組,故答案為:H2O,H2;CO,CO2;
(2)因n(CO2)平=bmol,由方程式 2CO(g)+O2(g)?2CO2(g),可知平衡時反應消耗的O2為$\frac{b}{2}$mol,則反應2H2O(g)?2H2(g)+O2(g)中生成O2的物質的量為(a+$\frac{b}{2}$)mol,消耗的水為2×(a+$\frac{b}{2}$)mol=(2a+b)mol,所以n(H2O)平=2mol-(2a+b)mol=(2-2a-b)mol,
故答案為:(2-2a-b)mol.
點評 本題考查化學平衡的計算,題目難度中等,(1)為易錯點,注意分析兩個方程式的特點.


科目:高中化學 來源: 題型:解答題
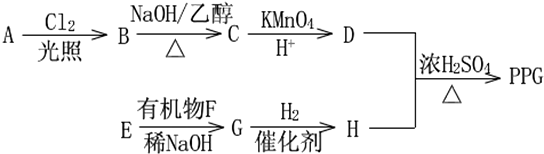

 .
. .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 電離常數 | 4.9×10-10 | 7.2×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | HF | C. | CH3COOH | D. | HNO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使紫色石蕊試紙變紅色的溶液:K+、Fe2+、NO3-、Ca2+ | |
| B. | 加入鋁粉產生氫氣的溶液:SO42-、Cl-、K+、Mg2+ | |
| C. | 含有較多Al3+的溶液:SO42-、Na+、Mg2+、NO3- | |
| D. | 含有較多Fe2+的溶液:Na+、SO42-、ClO-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用物質A表示的反應的平均速率為0.3 mol•L-1•s-1 | |
| B. | 2s時的壓強是起始時的1.1倍 | |
| C. | 2s時物質A的轉化率為30% | |
| D. | 2s時物質B的濃度為0.7mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com