
【題目】短周期元素X、Y、Z在元素周期表中的相對位置如表所示,其中X、Y、Z元素的原子最外層電子數之和為15。下列說法正確的是( )
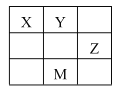
A.原子半徑大小:Z>Y>X
B.簡單氫化物沸點:X>Y
C.Z元素與X元素可形成直線形的共價化合物
D.M的原子序號為33,其最高價氧化物對應的水化物為強酸
【答案】C
【解析】
短周期元素X、Y、Z在元素周期表中的相對位置如表所示,則X、Y為二周期,Z為三周期,M為四周期,設Y的最外層電子數為a,X的最外層電子數為a-1,Z的最外層電子數為a+1,a-1+a+a+1=15,a=5,則Y為氮,X為碳,Z為硫,M為砷。
A.原子半徑從左到右依次減小,從上到下依次增大,故原子半徑大小:Z>X>Y,A不正確;
B. X簡單氫化物為甲烷,Y的簡單氫化物為氨氣,氨氣分子間可以形成氫鍵,沸點更高,故沸點:Y>X,B不正確;
C. Z元素與X元素可形成CS2,CS2為SP2雜化,為直線形的共價化合物,C正確;
D. M為砷,原子序號為33,磷酸為中強酸,而砷的非金屬性小于N,非金屬性越弱,其最高價氧化物對應的水化物的酸性越弱,故砷的最高價氧化物對應的水化物不可能是強酸,D不正確。
答案選C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】A、B、W、D、E為短周期元素,且原子序數依次增大,質子數之和為39,B、W同周期,A、D同主族,A、W能形成兩種液態化合物A2W和A2W2,E 元素的周期序數與主族序數相等。
(1)E 元素在周期表中的位置___________。
(2)寫出A2W2的電子式為____________。
(3)廢印刷電路板上含有銅,以往的回收方法是將其灼燒使銅轉化為氧化銅,再用硫酸溶解。現改用A2W2和稀硫酸浸泡廢印刷電路板既達到上述目的,又保護了環境,試寫出反應的離子方程式________。
(4)元素D的單質在一定條件下,能與 A 單質化合生成一種化合物DA,熔點為800℃,DA能與水反應放氫氣,若將1molDA和1molE 單質混合加入足量的水,充分反應后成氣體的體積是_________(標準狀況下)。
(5)D的某化合物呈淡黃色,可與氯化亞鐵溶液反應。若淡黃色固體與氯化亞鐵反應的物質的量之比為1:2,且無氣體生成,則該反應的離子方程式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】紅斑素、紅曲素是常用于糖果、雪糕等食品的著色劑的主要成分,結構如圖所示。
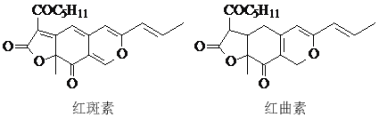
下列說法正確的是( )
A.紅斑素和紅曲素互為同分異構體
B.紅斑素和紅曲素都能與NaOH溶液反應
C.紅斑素中含有醚鍵、羰基等三種含氧官能團
D.紅曲素最多能與6molH2加成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為探究Na與C02反應產物,某化學興趣小組按如圖裝置進行實驗。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列問題:
(1)寫出A中反應的離子方程式_____________________________________;
(2)儀器X的名稱是____________________,B中的溶液為_____________________;
(3)先稱量硬質玻璃管的質量為mlg,將樣品裝入硬質玻璃管中,稱得樣品和硬質玻璃管的總質量是m2g.再進行下列實驗操作,其正確順序是____________(填標號);
a.點燃酒精燈,加熱 b.熄滅酒精燈 c.關閉K1和K2
d.打開K1和K2,通入C02至E中出現渾濁 e.稱量硬質玻璃管 f.冷卻到室溫
重復上述操作步驟,直至硬質玻璃管恒重,稱得質量為m3g。
(4)加熱硬質玻璃管一段時間,觀察到以下現象:
①鈉塊表面變黑,熔融成金屬小球;
②繼續加熱,鈉迅速燃燒,產生黃色火焰。反應完全后,管中有大量黑色物質;
③F中試管內壁有銀白物質產生。
產生上述②現象的原因是______________________________________;
(5)探究固體產物中元素Na的存在形式
假設一:只有Na2CO3;
假設二:只有Na2O;
假設三:Na2O和Na2CO3均有
完成下列實驗設計,驗證上述假設:
步驟 | 操作 | 結論 |
1 | 將硬質玻璃管中的固體產物溶于水后過濾; | 假設一成立 |
2 | 往步驟1所得濾液中_________________________________; 現象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根據上述實驗現象及下表實驗數據,寫出Na與CO2反應的總化學方程式____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A.乙醛與新制氫氧化銅懸濁液加熱反應:CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
B.向加碘食鹽(含碘酸鉀)中加入碘化鉀溶液和稀硫酸:IO3-+I-+6H+=I2+3H2O
C.偏鋁酸鈉溶液中通入過量二氧化碳:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.亞硫酸鈉水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A.0.1mol·L1NaOH溶液從常溫升溫到60℃,其pH變小
B.等濃度的氨水、NaOH溶液加入稀鹽酸至中性,則c(NH4+)=c(Na+)
C.等濃度的氨水、NaOH溶液稀釋相同的倍數,pH后者大
D.等體積、等pH的氨水、NaOH溶液加入足量的AlCl3溶液,產生沉淀的質量前者大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用滴有酚酞和氯化鈉溶液濕潤的濾紙分別做甲、乙兩個實驗,下列判斷錯誤的是( )

A.b極附近有氣泡冒出B.d極附近出現紅色
C.a、c極上都發生氧化反應D.甲中鐵棒比乙中鐵棒更易腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】制備鋅印刷電路板是用稀硝酸腐蝕鋅板產生的廢液稱“爛板液”。“爛板液”中除含硝酸鋅外,還含有自來水帶入的Cl-和Fe3+,在實驗室里,用“爛板液制取ZnSO47HO的過程如圖所示
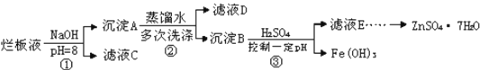
(1)若稀硝酸腐蝕鋅板時還原產物為N2O,氧化劑與還原劑的物質的量之比是_________
(2)若步驟①的pH>12,則Zn(OH) 2溶解生成偏鋅酸鈉,Zn(OH) 2溶解的離子方程式為___________________________
(3)濾液D中除了含有OH-離子外,還含有的陰離子有___________(填離子符號)
(4)若濾液E的pH=4,c(Zn2+)=2mol·L-1,(Fe3+)=2.6×10-9mo·L-l試求出Fe(OH)3的溶度積常數________________(只寫結果)
(5)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq)H=a kJ mol·L-1
②H2O(l) H+(aq)+OH-(aq)H=b kJ·mol·L-1
若①的溶度積常數為Ksp,②的離子積常數為Kw,Fe3+發生水解反應的平衡常數:K=______________(用含Kw、Ksp的代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅錳干電池的負極材料是電池殼體的金屬鋅,正極是被二氧化錳和碳粉包圍的石墨電極,電解質是氯化鋅和氯化銨的糊狀物,該電池放電過程中產生Mn2O3。利用廢舊電池回收Zn、Mn化合物,對環境保護意義重大。
步驟一:向除去殼體及石墨電極的黑色糊狀物中加水,攪拌,充分溶解,經過濾分離得到固體和濾液。
步驟二:處理固體,提取MnO2通過對獲得的濾渣進行灼燒,灼燒的目的是__。灼燒時用到的實驗儀器有酒精燈、玻璃棒、__。
步驟三:處理濾液,得到ZnCl2·xH2O晶體,再通過將SOCl2與ZnCl2·xH2O晶體混合可制取無水ZnCl2。有關的實驗裝置如圖(夾持及加熱裝置略):
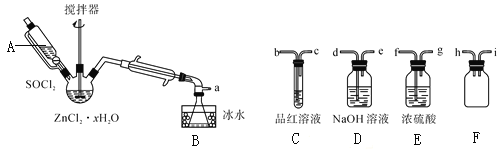
已知:SOCl2是一種常用的脫水劑,熔點-105℃,沸點79℃。140℃以上易分解,與水劇烈反應生成兩種氣體。
①儀器A的名稱為__。
②蒸餾燒瓶中發生反應的化學方程式為:__。
③為回收剩余的SOCl2并驗證生成物中含有SO2。上述儀器接目的連接響序為a→__。裝置E中濃硫酸的作用___。
④為提高SOCl2的利用率,該實驗宜采用的加熱方式為__。
⑤討論:將ZnCl2·xH2O晶體置于坩堝中加熱均燒,__(能,不能)得到無水ZnCl2,原因是__。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com