
已知一定條件下體積不變的密閉容器中(各物質均為氣態),1 mol N2和3 mol H2充分反應生成 NH3放熱為Q1 kJ,下列說法正確的是
A.上述反應的熱化學方程式為:N2(g)+3H2(g)  2NH3(g) ΔH=- Q 1 kJ/mol
2NH3(g) ΔH=- Q 1 kJ/mol
B.相同條件下1 mol N2 (g)和 3 mol H2(g) 的總鍵能小于2molNH3(g)的總鍵能
C.相同條件下將2 molN2 和6molH2置于相同容器中充分反應后放出的熱量為 Q 2 kJ,Q2 =2Q1
D.相同條件下氣體密度不變時,可以判斷反應 N2(g)+3H2 (g) 2NH3 (g)達到平衡狀態
2NH3 (g)達到平衡狀態
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2015-2016學年海南嘉積中學高二下期中理科化學試卷(解析版) 題型:推斷題
I、白藜蘆醇的結構簡式如下圖。它廣泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性。下列有關白藜蘆醇的說法正確的是
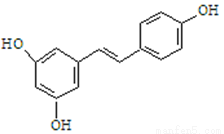
A.該有機物屬于醇類
B.1mol該有機物與H2加成時最多消耗1mol H2
C.1mol該有機物與Br2反應時最多消耗6mol Br2
D.1mol該有機物最多消耗3mol NaOH
Ⅱ、根據下列的有機物合成路線回答問題:
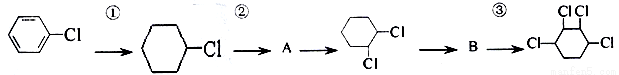
(1)寫出A、B的結構簡式:A 、B 。
(2)寫出各步反應類型:
① 、② 、③ 。
(3)寫出②、③的反應方程式:
②
③
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏銀川二中高三三模理綜化學試卷(解析版) 題型:填空題
【化學-選修3:物質結構與性質】
X、Y、Z、R為前四周期原子序數依次增大的元素。X的單質與氫氣可化合生成氣體G.,其水溶液pH>7;Y的原子中最外層電子數是內層電子數的3倍;Z的單質是一種黃色晶體;R基態原子3d軌道的電子數是4s軌道電子數的3倍。
請回答下列問題:
(1)Z元素在周期表中的位置________________;其單質的晶體類型是________________;X和Y元素的第一電離能較小的是___________(填元素名稱);
(2)在Y、 Z的簡單氫化物中,Y的氫化物更易溶于乙醇,其原因是_____________;G在一定條件下可與CO2反應生成一種最常見的氮肥M,M中所含元素原子的雜化方式為_____________;
(3) R單質與Z單質化合的產物J中,R離子的核外電子排布式是_____________;己知J與足量強堿性的NaC1O溶液在一定條件下反應,生成一種具有強氧化性的R的含氧酸根,該反應的離子方程式為_____________;
(4) G分子的立體構型為_______;R可形成化合物R(CO)5,該化合物中所含化學鍵的類型為_______;
(5) X與硼元素形成的化合物BX,其晶胞結構如圖所示,該晶胞中含有的X原子數目為_____________;若最近的X、B原子之間的距離為anm,NA代表阿伏加德羅常數,則該晶體的密度為_____________g/cm
3(列式表示,不必化簡)。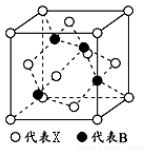
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都石室中學高二4月月考化學試卷(解析版) 題型:選擇題
已知:常溫下濃度為0.1 mol·L -1 的下列溶液的 pH 如表:

下列有關說法正確的是
A.根據上表,向足量NaClO溶液中通入CO2:CO2 + H2O+2ClOˉ 2HClO + CO32-
2HClO + CO32-
B.向上述 NaClO溶液中通HF氣體至恰好完全反應時:c (Na+)>c(Fˉ)>c(HClO)
C.在相同溫度下,同濃度的三種酸溶液的導電能力順序:H2CO3<HClO<HF
D.若將CO2通入0.1 mol·L -1 Na2CO3溶液中至溶液中性,則溶液中2c(CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都石室中學高二4月月考化學試卷(解析版) 題型:選擇題
關于電化學的下列說法正確的是

A.工業上用電解MgCl2溶液的方法冶煉Mg
B.鋼鐵發生吸氧腐蝕的正極反應式為4OH﹣-4e﹣═O2↑+2H2O
C.如圖14-C中發生反應的方程式為:Fe+2H+=Fe2++H2↑
D.堿性鋅錳干電池放電時的正極反應為: MnO2+H2O+e-=MnOOH+OH-
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都石室中學高二4月月考化學試卷(解析版) 題型:選擇題
下列說法中正確的是
A.碳原子數≤10 的烷烴,其一氯代物沒有同分異構體的烷烴共有3種
B.烯烴、炔烴、芳香烴都能與溴水反應而使其褪色
C.等質量的CH≡CH和C6H6完全燃燒時消耗等物質的量的氧氣
D.分子式為C6H12與C3H6的兩種烴一定互為同系物
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏石嘴山三中高三下四模理綜化學試卷(解析版) 題型:填空題
二氧化氯(ClO2)是國內外公認的高效、廣譜、快速、安全無毒的殺菌消毒劑,被稱為“第4代消毒劑”。工業上可采用氯酸鈉(NaClO3)或亞氯酸鈉(NaClO2)為原料制備ClO2。
(1)亞氯酸鈉也是一種性能優良的漂白劑,但在強酸性溶液中會發生歧化反應,產生ClO2氣體,離子方程式為___________________________;向亞氯酸鈉溶液中加入鹽酸,反應劇烈。若將鹽酸改為相同pH的硫酸,開始時反應緩慢,稍后一段時間產生氣體速率迅速加快。產生氣體速率迅速加快的原因是 。
(2)化學法可采用鹽酸或雙氧水還原氯酸鈉制備ClO2。用H2O2作還原劑制備的ClO2更適合用于飲用水的消毒,其主要原因是 。
(3)電解法是目前研究最為熱門的生產ClO2的方法之一。如圖所示為直接電解氯酸鈉、自動催化循環制備高純ClO2的實驗。
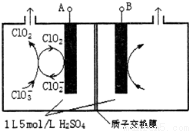
①電源負極為___________________極(填A或B)
②寫出陰極室發生反應的電極反應式和離子方程式
_______________________ ___ ; 。
③控制電解液H+不低于5mol/L,可有效防止因H+濃度降低而導致的ClO2—歧化反應。若兩極共收集到氣體22.4L(體積已折算為標準狀況,忽略電解液體積的變化和ClO2氣體溶解的部分),此時陽極室與陰極室c(H+)之差為_________________。
查看答案和解析>>
科目:高中化學 來源:2016屆海南省高三第九次月考化學試卷(解析版) 題型:填空題
(1)在298K,100kPa時.CH4的燃燒熱是890.0kJ/mol,寫出該反應的熱化學方程式__________。現有CH4和CO的混合氣體0.75mol,完全燃燒后,生成CO2氣體和18g液態水,共放出QkJ熱量(假定熱量未損失),則CH4和CO的物質的量的比為__________。
(2)利用甲烷的燃燒反應設計一個燃料電池,用氫氧化鉀溶液作電解質溶液.多孔石墨作電極,在電極上分別通入甲烷和氧氣,通入甲烷氣體的電極上發生的電極反應是___________,當電路中轉移12mol電子時,實際提供的電能是890.0kJ,則該電池的能量轉化效率是__________。
(3)將鐵棒和石墨棒插入盛有飽和NaCl溶液的U形管中形成如圖裝置:

①當開關K1閉合,則鐵發生電化學腐蝕中的__________腐蝕。
②當開關K2閉合,則總反應的離子方程式為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com