
根據下列反應判斷氧化劑的氧化性由強到弱的順序正確的是 ( )
① Cl2+2KI══I2+2KCl
② 2FeCl3+2HI══I2+2FeCl2+2HCl
③ 2FeCl2+Cl2══2FeCl3
④ I2+SO2+2H2O══2HI+H2SO4
A. Cl2>I2>Fe3+>SO2
B. Cl2>Fe3+>I2>SO2
C. Fe3+>Cl2>I2>SO2
D. Cl2>Fe3+>SO2>I2
科目:高中化學 來源:2017屆河南省南陽、信陽等六市高三第一次聯考理綜化學試卷(解析版) 題型:選擇題
下列有關有機物的說法中
①結構片段為……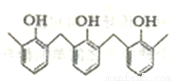 ……的高聚物,其單體是甲醛和苯酚
……的高聚物,其單體是甲醛和苯酚
②標準狀況下,22.4LHF所含電子數約為10NA
③甲醇通常是一種有毒的氣體,分子中只含極性鍵
④苯酚和碳酸鈉溶液的反應: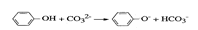
⑤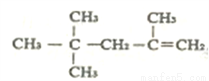 的名稱為:2,4,4,-三甲基-1-戊烯
的名稱為:2,4,4,-三甲基-1-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能處于同一平面
⑦等物質的量的苯與苯甲酸完全燃燒消耗氧氣的量不相等
其中正確的有 個。
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化學 來源:2017屆山東省臨沂市高三上學期期末考試化學試卷(解析版) 題型:選擇題
一定條件下,可逆反應的平衡常數可以用平衡濃度計算,也可以用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數。在恒溫恒壓條件下,總壓不變,用平衡分壓計算平衡常數更方便。下列說法不正確的是 ( )
A. 對于C2H4(g)+H2O(g)=C2H5OH(g)在一定條件下達到平衡狀態時,體系的總壓強為P,其中C2H4(g)、H2O(g)、C2H5OH(g)均為1mol,則用分壓表示的平衡常數Kp=
B. 恒溫恒壓下,在一容積可變的容器中,反應2A(g)+B(g)=2C(g)達到平衡時,A、B和C的物質的量分別為4mol、2mol和4mol。若此時A、B和C均增加1mol,平衡正向移動
C. 一恒溫恒壓下,在一容積可變的容器中,N2(g)+3H2(g)=2NH3(g)達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3molN2,則平衡正向移動
D. 對于一定條件下的某一可逆反應,用平衡濃度表示的平衡常數和用平衡分壓表示的平衡常數,其數值不同,但意義相同,都只與溫度有關
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省濟南市高一下學期開學考試化學試卷(解析版) 題型:選擇題
下列事實不能用于判斷金屬性強弱的是( )
A. 金屬間發生的置換反應
B. 1mol金屬單質在反應中失去電子的多少
C. 金屬元素的最高價氧化物對應水化物的堿性強弱
D. 金屬元素的單質與水(或酸)反應置換出氫氣的難易程度
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省濟南市高一下學期開學考試化學試卷(解析版) 題型:選擇題
將2.56 g Cu和一定量的濃HNO3反應,隨著Cu的不斷減少,反應生成氣體的顏色逐漸變淺,當Cu反應完畢時,共收集到氣體1.12 L(標準狀況),則反應中消耗HNO3的物質的量為( )
A. 0.05 mol B. 1 mol C. 1.05 mol D. 0.13 mol
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省濟南市高一下學期開學考試化學試卷(解析版) 題型:選擇題
在Al2(SO4)3、K2SO4和明礬的混合液中,如果SO42-的物質的量濃度為0.2 mol·L-1,當加入等體積的0.2 mol·L-1的KOH溶液時,生成的沉淀恰好溶解,則原混合物中K+的物質的量濃度是( )
A. 0.2 mol·L-1 B. 0.25 mol·L-1
C. 0.225mol·L-1 D. 0.45 mol·L-1
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省濟南市高一下學期開學考試化學試卷(解析版) 題型:選擇題
在溶液中加入足量Na2O2后仍能大量共存的離子組是( )
A. K+、AlO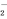 、Cl-、SO
、Cl-、SO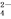
B. H+、Ba2+、Cl-、NO
C. Ca2+、Fe2+、NO 、HCO
、HCO
D. Na+、Cl-、CO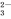 、SO
、SO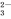
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省高二下學期學業水平模擬化學試卷(解析版) 題型:選擇題
將3.80g碳酸鈉和碳酸氫鈉的固體混合物加入120mL 0.5mol•L-1的的鹽酸中,充分反應后得到溶液W。下列說法一定正確的是
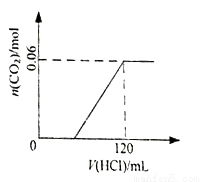
A. 溶液W中含有鹽酸 B. 生成氣體的物質的量與消耗鹽酸體積的關系如右圖
C. 將溶液W蒸發結晶所得固體質量為3.51g D. 將固體混合物充分加熱后再加入120mL 0.5mol•L-1的鹽酸,所得溶液組成和W相同
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三下學期期初考試化學試卷(解析版) 題型:選擇題
在某溫度下,向三個初始體積均為1L的密閉容器中按下表所示投料,發生反應:2SO2(g)+O2(g)  2SO3(g)△H<0。達到平衡進,下列說法正確的是
2SO3(g)△H<0。達到平衡進,下列說法正確的是
容器編號 | 容器類型 | 起始物質的量/mol | 平衡時SO3的 物質的量/mol | ||
SO2 | O2 | SO3 | |||
Ⅰ | 恒溫恒容 | 2 | 1 | 0 | 1.2 |
Ⅱ | 絕熱恒容 | 0 | 0 | 2 | a |
Ⅲ | 恒溫恒壓 | 2 | 1 | 0 | b |
A. 平衡時SO3的物質的量:a>1.2、b>1.2
B. 容器Ⅱ、Ⅲ中平衡常數相同
C. 容器I中SO2的轉化率與容器Ⅱ中SO3的轉化率之和小于1
D. 若起始時向容器Ⅰ中充入1.0molSO2(g)、0.40molO2(g)和1.40molSO3(g),則此時V正<V逆
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com