
實驗室用鋅粒和稀硫酸反應制取H2,下列措施可使反應速率減慢的是
A. 向稀硫酸中加水 B. 增加鋅粒的量
C. 用鋅粉代替鋅粒 D. 升高反應溫度
 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:高中化學 來源:2016-2017學年山西省高二下學期第一次月考化學試卷(解析版) 題型:選擇題
研究有機物一般經過以下幾個基本步驟:分離、提純→確定實驗式→確定分子式→確定結構式,以下用于研究有機物的方法錯誤的是
A.蒸餾可用于分離提純液態有機混合物
B.核磁共振氫譜通常用于分析有機物的相對分子質量
C.燃燒法是研究確定有機物成分的有效方法
D.對有機物分子紅外光譜圖的研究有助于確定有機物分子中的官能團
查看答案和解析>>
科目:高中化學 來源:2017屆河南省鄭州、平頂山、濮陽市高三第二次質量預測(二模)理綜化學試卷(解析版) 題型:簡答題
氯化亞銅(CuCl)廣泛應用于化工、印染、電鍍等行業。CuCl難溶于醇和水,在潮濕空氣中易水解氧筑化,且在氯離子濃度較大的體系中存在CuCl+Cl-=[CuCl2]-。工業上用低品銅礦(主要含CuS、Cu2S、FeO等)制備CuCl的一種工藝流程如下:
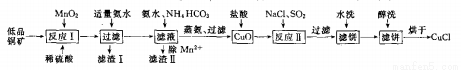
回答下面問題:
(1)反應I中被氧化的元素有_________。(填元素符號)
(2)濾渣II的成分主要為MnCO3,寫出除Mn2+的離于方程式_________。
(3)寫出反應II中發生反應的離子方程式_________。
(4)在進行反應II時,通入的SO2一般都要適當過量,目的是_________。
(5)濾餅進行醇洗的目的是_________。
(6)在進行反應II時,當氯化鈉用量增加到一定程度后氯化亞銅的沉淀率減小,原因是_________。
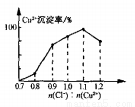
(7)Cu2+的沉淀率是指轉化為CuCl的n(Cu2+)占總的n(Cu2+)的百分比。在一定條件下Cu2+沉淀率與沉淀前的Cl-、Cu2+的物質的量之比[n(Cl-): n(Cu2+)]的關系如下圖所示。CuCl+Cl- [CuCl2]-的平衡常數K=6.5×10-2,則該條件下Cu2+的最大沉淀率為_________。(保留兩位小數)。
[CuCl2]-的平衡常數K=6.5×10-2,則該條件下Cu2+的最大沉淀率為_________。(保留兩位小數)。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省高二學業水平測試化學試卷(解析版) 題型:選擇題
下列物質轉化常通過加成反應實現的是
A.  B. CH3CH2OH→CH3CHO
B. CH3CH2OH→CH3CHO
C. CH4→CH3Cl D. CH2=CH2→CH3CH2Br
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省高二學業水平測試化學試卷(解析版) 題型:選擇題
下列有關苯、乙酸、乙醇說法正確的是
A. 都易溶于水 B. 苯易與液溴發生加成反應
C. 乙酸溶液的pH小于7 D. 乙醇不能與金屬鈉反應
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省高二學業水平測試化學試卷(解析版) 題型:選擇題
下列詩句描述的過程包含化學變化的是
A. 千錘萬鑿出深山 B. 雪融山頂響流泉
C. 吹盡狂沙始到金 D. 蠟炬成灰淚始干
查看答案和解析>>
科目:高中化學 來源:2016-2017學年貴州省高一下學期第一次月考理科綜合化學試卷(解析版) 題型:填空題
下表是元素周期表的一部分,請回答有關問題:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)表中化學性質最不活潑的元素,其原子結構示意圖為 _________________。
(2)由表中兩種元素的原子按1:1組成的常見液態化合物的稀液易被催化分解,可使用的催化劑為(填序號)____。
a.MnO2 b.KMnO4 c.Na2SO3
(3)④、⑦、⑩的原子半徑由大到小的順序 __________________(填元素符號) 。
(4)④、⑦的氫化物的穩定性最強的是 __________(填化學式)。
(5)⑨元素單質與水反應的離子方程式是 ______________________________。
(6)設計實驗方案:比較⑦與⑩單質氧化性的強弱,請將方案填入下表。
實驗步驟 | 實驗現象與結論 |
________ | ________ |
查看答案和解析>>
科目:高中化學 來源:2017屆河南省豫南九校高三下學期質量考評七理綜化學試卷(解析版) 題型:選擇題
下列操作不能達到目的的是
選項 | 目的 | 操作 |
A | 配制100mL1.0mol/LCuSO4溶液 | 將25.0gCuSO4·5H2O溶于100mL蒸餾水中 |
B | 除去NaCl固體中少量的Na2CO3 | 將混合物溶于水,再加入稍過量的鹽酸,再加熱蒸發結晶 |
C | 使Na2SO3溶液中的SO32-完全轉化為SO42- | 向Na2SO3溶液中加入過量的H2O2溶液 |
D | 確定KI溶液中的碘離子是否被部分氧化 | 取少量溶液于試管中,向其中滴加少量淀粉溶液,觀察溶液是否變藍色,再另取少量溶液滴加AgNO3溶液,觀察溶液是否產生黃色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2017屆貴州省貴陽市高三下學期第六次適應性考試理綜化學試卷(解析版) 題型:推斷題
U、V、W、X、Y、Z是原子序數依次增大的短周期元素。已知:
①WU4++XU-==WU3+U2X,各種反應物和生成物的電子總數都與Y+相等;
②Z的單質在X2中燃燒的產物可使品紅溶液褪色;
③V的單質在X2中燃燒可生成VX和VX2兩種氣體;
④Y的單質是一種金屬,該金屬與X2反應可生成Y2X和Y2X2兩種固體。
請回答下列問題:
(1)寫出Y2X2與水反應的化學方程式:________________。
(2)V、W、X形成的10電子氫化物中,沸點最高的是__________(寫化學式)。
(3)U2X2與FeSO4按物質的量之比1:2溶于稀硫酸中,反應的離子方程式為__________。
(4)常溫下,向pH=11的Y2VX3溶液中加入過量石灰乳,過濾后所得溶液pH=13,則反應前的溶液中與反應后的濾液中水電離出的c(OH-)的比值是_________。
(5)已知由U、W兩種元素組成的共價化合物聯氨的球棍模型如圖所示,則聯氨分子的電子式為____________。聯氨為二元弱堿,在水中的電離方程式與氨相似,聯氨第一步電離反應的平衡常數值為_______(已知:N2H4+H+==N2H5+的K=8.7×107;KW=1.0×10-14)。聯氨與過量硫酸形成的酸式鹽的化學式為______________。
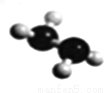
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com