
【題目】下列說法中正確的是( )
A. s能級的能量一定比p能級低 B. 電子云圖中小黑點多的區域表示電子多
C. 3p2表示第三能層上有兩個電子 D. 同一原子中,2p、3p、4p能級的軌道數相等
 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:
【題目】煤炭燃燒過程中會釋放出大量的SO2,嚴重破壞生態環境。采用一定的脫硫技術可以把硫元素以CaSO4的形式固定,從而降低SO2的排放。但是煤炭燃燒過程中產生的CO又會與CaSO4發生化學反應,降低脫硫效率。相關反應的熱化學方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反應Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反應Ⅱ)
請回答下列問題:
(1)假設某溫度下,反應Ⅰ的速率(v1)大于反應Ⅱ的速率(v2),則下列反應過程能量變化示意圖正確的是_____________。

(2)通過監測反應體系中氣體濃度的變化可判斷反應Ⅰ和Ⅱ是否同時發生,理由是 ______________。

(3)在溫度、容積相同且不變的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如圖二(已知2SO2(g)+O2(g)=2SO3(g) △H=196.6kJ·mol-1)
A.2c1______c3 B.a+b______196.6 C.2p2______p3 D.α1+α3______1(填>,=,<)
(4) “亞硫酸鹽法”吸收煙氣中的SO2。室溫條件下,將煙氣通入氨水溶液中,測得溶液pH與含硫組分物質的量分數的變化關系如圖三所示。
請寫出a點時n(HSO3-):n(H2SO3)=______,b點時溶液pH=7,則n(NH4+):n(HSO3-)=___。
(5)催化氧化法去除NO,一定條件下,用NH3消除NO污染,其反應原理為4NH3+6NO![]() 5N2+ 6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4:l、3:l、1:3時,得到NO脫除率曲線如圖四所示:
5N2+ 6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4:l、3:l、1:3時,得到NO脫除率曲線如圖四所示:
①曲線c對應NH3與NO的物質的量之比是______。
② 曲線a中NO的起始濃度為6×10-4mg/m3,從A點到B點經過0.8s,該時間段內NO的脫除速率為_____mg/(m3·s)。
(6)已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9,向0.4mol/LNa2SO4的溶液中加入足量BaCO3粉末(忽略體積變化),充分攪拌,發生反應SO![]() (aq)+BaCO3 (s) BaSO4 (s)+CO
(aq)+BaCO3 (s) BaSO4 (s)+CO![]() (aq) 靜置后沉淀轉化達到平衡。此時溶液中的c(SO
(aq) 靜置后沉淀轉化達到平衡。此時溶液中的c(SO![]() )=________mol·L-1(小數點后兩位).
)=________mol·L-1(小數點后兩位).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現用傳感技術測定噴泉實驗中的壓強變化來認識噴泉實驗的原理。下列說法正確的是
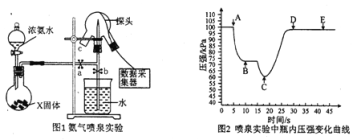
A. 制取氨氣時燒瓶中的固體常用CaO或CaCl2
B. 噴泉實驗結束后,發現水未充滿三頸燒瓶,肯定是因為裝置的氣密性不好
C. 關閉a,將單孔塞(插有吸入水的膠頭滴管)塞緊頸口c,打開b,完成噴泉實驗,電腦繪制三頸燒瓶內壓強變化曲線如圖2,則E點時噴泉最劇烈
D. 工業上,若出現液氨泄漏,噴稀鹽酸比噴水處理效果好
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用惰性電極電解下列溶液,一段時間后,再加入一定質量的另一物質中(括號內),溶液能與原來溶液完全一樣的是
A. CuCl2 [CuSO4] B. NaOH [NaOH] C. NaCl [HCl] D. CuSO4 [Cu(OH)2]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的鹽酸跟過量的鐵粉反應時,為了減緩反應速率但不影響生成H2的總量,可向鹽酸中加入適量的( )
A.CaCO3(s)B.KNO3溶液
C.Na2SO4溶液D.CuSO4(s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】300 ℃時,將2 mol A和2 mol B兩種氣體混合于2 L密閉容器中,發生如下反應:3A(g)+B(g)![]() 2 C(g)+2D(g) ΔH=Q, 2 min末達到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末達到平衡,生成0.8 mol D。
(1)300℃時,該反應的平衡常數表達式為K=______________,已知K300℃<K350℃,則ΔH____0(填“>”或“<”)。
(2)在2 min末時,B的平衡濃度為________,D的平均反應速率為________。
(3)若溫度不變,縮小容器容積,則A的轉化率________(填“增大”“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷是天然氣的主要成分,是一種重要的清潔能源和化工原料。
(1)用煤制天然氣時會發生多個反應,通過多種途徑生成CH4。
已知:C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
CO(g)+3H2(g)![]() CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
寫出CO與H2O (g)反應生成H2和CO2的熱化學方程式____________________________________。
(2)天然氣中含有H2S雜質,某科研小組用氨水吸收得到NH4HS溶液,已知T℃k(NH3H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子濃度大小關系正確的是______________。
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b. c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工業上常用CH4與水蒸氣在一定條件下來制取H2,其原理為:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
①一定溫度時,在一個體積為2L的恒容密閉容器中,加入1molCH4和1.4mol水蒸氣發生上述反應,5min后達平衡,生成0.2molCO,用H2表示該反應的速率為_______________,此反應的平衡常數為__________________(結果保留到小數點后三位)
②下列說法中能說明此反應達到平衡狀態的是____________。
A.體系的壓強不再發生變化 B.生成1mol CH4的同時消耗3mol H2
C.各組分的物質的量濃度不再改變 D.體系的密度不再發生變化
E.反應速率V(CH4) :V(H2O) :v(CO) :v(H2)= 1:1:1:3
(4)甲醇水蒸氣重整制氫反應:CH3OH(g)+H2O(g)![]() CO2(g) +3H2(g) ΔH = +49kJ·mol-1
CO2(g) +3H2(g) ΔH = +49kJ·mol-1
①分析適當增大水醇比[n(H2O) ∶n (CH3OH)]對甲醇水蒸氣重整制氫的好處____________。
②某溫度下,將[n(H2O) ∶n (CH3OH)]=l∶1的原料氣充入恒容密閉容器中,初始壓強為p1,反應達到平衡時總壓強為p2,則平衡時甲醇的轉化率為______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置進行實驗,將液體A逐滴加入到固體B中,下列敘述中不正確的是( )

A. 若A為醋酸,B為貝殼(粉狀),C為澄清石灰水溶液,則C中溶液變渾濁
B. 若A為濃鹽酸,B為鋅粒,C中盛滴有酚酞的NaOH溶液,則C中溶液褪色
C. 若A為雙氧水,B為MnO2,C中為NaOH溶液,D為防倒吸裝置
D. 實驗中儀器D可起到防倒吸的作用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在標準狀況下,4.48LCH4和CO2的混合氣體質量為6.0g,則該混合氣體的平均摩爾質量為____,其中CH4和CO2的物質的量之比為____。
(2)將17.1gBa(OH)2溶解在水中,配成100mL溶液,配好后從中取出10mL溶液,加水稀釋至100mL,則稀釋后所得溶液中OH-的物質的量濃度是__________mol/L。
(3)在標準狀況下,VL某氣體(摩爾質量為Mg/mol)溶解在1L水(水的密度近似為1g/cm3)中,假設氣體完全溶解且不與水發生反應,所得溶液的密度為ρg/cm3,則所得溶液的物質的量濃度c=______mol/L(用以上字母表示,且必須化簡)。
(4)ZnSO4溶液中含有少量Fe2+,為了除去這種離子,調節溶液的pH為5,然后加入高錳酸鉀溶液,使之生成沉淀。已知高錳酸鉀的還原產物是MnO2,則該反應的離子方程式為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com