
【題目】A和B反應生成C,假定反應由A、B開始,它們的起始濃度均為1 mol/L。反應進行2 min后A的濃度為0.8 mol/L,B的濃度為0.6 mol/L,C的濃度為0.6 mol/L。則2 min內反應的平均速率v(A)=__________。該反應的化學反應方程式為:__________________________。
【答案】0.1 mol·L-1·min-1A+2B=3C
【解析】
根據A的濃度的變化量和時間來計算,利用A來表示的化學反應速率,利用反應速率之比等于化學計量數之比來書寫反應的方程式。
A的起始濃度均為1mol/L,反應進行2min后A的濃度為0.8mol/L,
則平均速率v(A)=![]() =0.1 mol·L-1·min-1,
=0.1 mol·L-1·min-1,
同理平均速率v(B)=![]() =0.2 mol·L-1·min-1,v(C)=
=0.2 mol·L-1·min-1,v(C)=![]() =0.3 mol·L-1·min-1,
=0.3 mol·L-1·min-1,
根據化學反應速率之比等于化學計量數之比,
則A、B、C的化學計量數之比為:0.1 mol·L-1·min-1:0.2 mol·L-1·min-1:0.3 mol·L-1·min-1=1:2:3,
該反應的化學反應方程式為A+2B=3C,
因此,本題正確答案是:0.1 mol·L-1·min-1 ;A+2B=3C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列說法及對應化學方程式或離子方程式正確的是( )
A. 用二氧化硅和水反應可制得硅酸:SiO2+H2O=H2SiO3
B. 食醋與蛋殼反應:CaCO3+2H+=Ca2++CO2↑+H2O
C. 鐵在氯氣中燃燒:Fe+Cl2=FeCl2
D. 84消毒液與潔廁靈混合可能產生毒氣:ClO-+Cl-+2H+=Cl2↑H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某溶液中只存在OH-、H+、CH3COO-、Na+四種離子,某同學推測其離子濃度大小順序有如下四種關系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)=c(Na+)>c(H+)=c(OH-)④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一種溶質,則該溶質是________,上述四種離子濃度的大小順序為________(填編號)。
(2)若該溶液是由體積相等的氫氧化鈉溶液和醋酸溶液混合而成,且恰好反應,則混合前兩溶液的物質的量濃度大小關系為c(NaOH)________c(CH3COOH)(填“大于”“小于”或“等于”,下同).
(3)若該溶液是由體積相等的氫氧化鈉溶液和醋酸溶液混合而成,且恰好是中性,則混合前兩溶液的物質的量濃度大小關系為c(NaOH)________c(CH3COOH)(填“大于”“小于”或“等于”),混合后溶液中的各離子濃度的大小關系為_______________________。
(4)25℃時,現有濃度均為0.10 mol·L-1的2種溶液:① 醋酸、② 氫氧化鈉。下列說法正確的是______(填字母)。
a.①中有CH3COO-發生水解,促進水的電離
b.②中由水電離出的c(H+)=1.0×10-13 mol·L-1
c.①和②等體積混合后:c(OH-)=c(H+)+c(CH3COOH)
d. ①和②混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 羥基與氫氧根離子有相同的化學式和電子式
B. 乙醇的官能團是—OH,可與NaOH溶液發生中和反應
C. 常溫下,1 mol乙醇可與足量的Na反應生成11.2 L H2
D. 已知乙醇的結構式如圖所示,則乙醇催化氧化時斷裂的化學鍵為①③
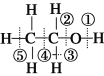
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】莽草酸可用于合成藥物達菲,其結構簡式如圖,下列關于莽草酸的說法 正確的是
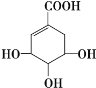
A. 分子式為C7H6O5
B. 分子中含有2種官能團
C. 可發生加成和酯化反應
D. 1mol莽草酸與足量的NaHCO3溶液反應可放出4molCO2氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下檸檬水的pH是3,純堿溶液的pH是11,兩溶液中的c(H+)濃度比為( )
A.3:11B.1:1C.10—3:10—11D.10—11:10—13
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,從A處通入新制備的氯氣,關閉旋塞B時,C處紅色布條無明顯的變化,打開旋塞B 時,C處紅色布條逐漸褪色。由此可判斷D瓶中裝的試劑不可能是

A. 濃硫酸B. 溴化鈉溶液C. Na2SO3溶液D. 硝酸鈉溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com