NA表示阿伏加德羅常數的值.下列敘述正確的是( )
A.33.6L(常溫常壓)氯氣與2.7g鋁充分反應,轉移電子數為0.3NA
B.標準狀況下,22.4L乙烷含有共價鍵數目為8NA
C.由NA個CO和NA個N2組成的混合物中含有10NA個電子
D.1L lmol?L-1的Na2SO4溶液中含有4NA個離子
【答案】
分析:A、常溫常壓下33.6L氯氣物質的量大于1,5mol,3Cl
2+2Al=2AlCl
3,反應定量關系分析氯氣過量;
B、依據標準狀況下氣體物質的量n=
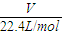
,結合乙烷分子結構計算共價鍵數;
C、N
A個CO為1mol含電子數14mol,N
A個N
2為1mol含電子數14mol,混合后含電子數28N
A;
D、n=Vc計算溶質物質的量為1mol,含離子為2molNa
+,1molSO
42-,含有3N
A個離子.
解答:解:A、常溫常壓下33.6L氯氣物質的量大于1.5mol,3Cl
2+2Al=2AlCl
3,反應定量關系分析氯氣過量,所以反應電子轉移用2.7g鋁計算得到,2.7g鋁物質的量為0.1mol,反應失去的電子數為0.3mol,故A正確;
B、標準狀況下乙烷氣體物質的量n=
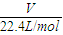
=1mol,1mol乙烷分子中含共價鍵數=1mol×(2-1+6)×NA/mol=7N
A,故B錯誤;
C、N
A個CO為1mol含電子數14mol,N
A個N
2為1mol含電子數14mol,混合后含電子數28N
A,故C錯誤;
D、n=Vc計算溶質物質的量為1mol,含離子為2molNa
+,1molSO
42-,含有3N
A個離子,故D錯誤;
故選A.
點評:本題考查了阿伏伽德羅常數的應用,主要是化學方程式的過量計算判斷,氧化還原反應的電子轉移計算,物質的量計算微粒數,題目難度中等.

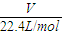 ,結合乙烷分子結構計算共價鍵數;
,結合乙烷分子結構計算共價鍵數;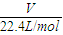 =1mol,1mol乙烷分子中含共價鍵數=1mol×(2-1+6)×NA/mol=7NA,故B錯誤;
=1mol,1mol乙烷分子中含共價鍵數=1mol×(2-1+6)×NA/mol=7NA,故B錯誤;
