
【題目】重鉻酸鉀是工業生產和實驗室的重要氧化劑,工業上常用鉻鐵礦(主要成分為FeO·Cr2O3,雜質為SiO2、Al2O3)為原料生產它,實數室模擬工業法用鉻鐵礦制K2Cr2O7的主要工藝如下圖。
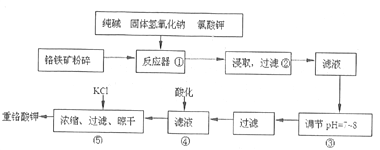
涉及的主要反應是:6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O。
12Na2CrO4+3Fe2O3+7KC1+12H2O。
(1)進入反應器①之前將鉻鐵礦粉碎的目的是____________________________。
(2)步驟②過濾得到的濾渣主要成分是_______________。過濾所需的玻璃儀器有_________________。
(3)操作④中酸化時,CrO42-轉化為Cr2O72-,寫出平衡轉化的離子方程式:_________________________。
(4)操作③調節溶液pH=7~8的目的是_________________________。
(5)工業上也常用電解法處理酸性含鉻廢水,用耐酸電解槽,鐵板作電極,槽中盛放酸性含Cr2O72-的廢水,原理示意圖如下圖。

B為電解池的________極,寫出陽極的電極反應式____________________。陽極區域溶液中發生反應的離子方程式為____________________________________。為了使Cr3+和Fe3+轉化為Fe(OH)3和Cr(OH)3沉淀,向反應后的溶液中加入一定量的燒堿,若溶液中c(Fe3+)=1.0×10-12mo1·L-1,則溶液中c(Cr3+)=_________mo1·L-1。{已如Ksp[Fe(OH)3]=4.0×10-28,Ksp[Cr(OH)3]=6.0×10-31}
【答案】 增大接觸面積,從而加快化學反應速率和提高原料的利用率 Fe2O3 燒杯、漏斗、玻璃棒 2CrO42-+2H+![]() Cr2O72-+H2O 將硅酸根離子和偏鋁酸根離子轉化為沉淀而除去 陰 Fe-2e-= Fe2+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 1.5×10﹣5
Cr2O72-+H2O 將硅酸根離子和偏鋁酸根離子轉化為沉淀而除去 陰 Fe-2e-= Fe2+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 1.5×10﹣5
【解析】試題分析:(1)將銘鐵礦粉碎的作用是增大接觸面積;(2)在反應器中主要發生6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O, SiO2、Al2O3與NaOH反應分別轉化為Na2SiO3和NaAlO2,產物中只有Fe2O3難溶于水;根據過濾裝置分析所需的玻璃儀器;(3)操作④中酸化時,CrO42-轉化為Cr2O72-,根據元素守恒、電荷守恒配平轉化的離子方程式;(4)調節溶液pH=7~8可以將硅酸根離子和偏鋁酸根離子轉化為沉淀而除去;(5)B電極生成氫氣,所以B是陰極;陽極生成Fe2+,陽極區域溶液中Fe2+把Cr2O72-還原為Cr3+;根據
12Na2CrO4+3Fe2O3+7KC1+12H2O, SiO2、Al2O3與NaOH反應分別轉化為Na2SiO3和NaAlO2,產物中只有Fe2O3難溶于水;根據過濾裝置分析所需的玻璃儀器;(3)操作④中酸化時,CrO42-轉化為Cr2O72-,根據元素守恒、電荷守恒配平轉化的離子方程式;(4)調節溶液pH=7~8可以將硅酸根離子和偏鋁酸根離子轉化為沉淀而除去;(5)B電極生成氫氣,所以B是陰極;陽極生成Fe2+,陽極區域溶液中Fe2+把Cr2O72-還原為Cr3+;根據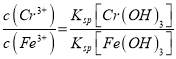 計算c(Cr3+)。
計算c(Cr3+)。
解析:(1)將銘鐵礦粉碎的作用是增大接觸面積,增大反應速率和提高原料的利用率;(2)反應器中主要發生6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O, SiO2、Al2O3與NaOH反應分別轉化為Na2SiO3和NaAlO2,產物中只有Fe2O3難溶于水,所以濾渣是Fe2O3;過濾所需的玻璃儀器有燒杯、漏斗、玻璃棒;(3)操作④中酸化時,CrO42-轉化為Cr2O72-,根據元素守恒、電荷守恒,反應的離子方程式是2CrO42-+2H+
12Na2CrO4+3Fe2O3+7KC1+12H2O, SiO2、Al2O3與NaOH反應分別轉化為Na2SiO3和NaAlO2,產物中只有Fe2O3難溶于水,所以濾渣是Fe2O3;過濾所需的玻璃儀器有燒杯、漏斗、玻璃棒;(3)操作④中酸化時,CrO42-轉化為Cr2O72-,根據元素守恒、電荷守恒,反應的離子方程式是2CrO42-+2H+![]() Cr2O72-+H2O;(4)調節溶液pH=7~8可以將硅酸根離子和偏鋁酸根離子轉化為沉淀而除去;(5)B電極生成氫氣,所以B是陰極;陽極鐵失電子生成亞鐵離子,電極反應式為Fe-2e-= Fe2+,陽極區域溶液中Fe2+把Cr2O72-還原為Cr3+,反應方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
Cr2O72-+H2O;(4)調節溶液pH=7~8可以將硅酸根離子和偏鋁酸根離子轉化為沉淀而除去;(5)B電極生成氫氣,所以B是陰極;陽極鐵失電子生成亞鐵離子,電極反應式為Fe-2e-= Fe2+,陽極區域溶液中Fe2+把Cr2O72-還原為Cr3+,反應方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O; 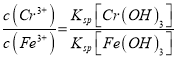 ,
, ![]() ,c(Cr3+)=1.5×10﹣5。
,c(Cr3+)=1.5×10﹣5。


 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:
【題目】(本題共8分)現有部分元素的性質與原子(或分子)結構如下表:
元素編號 | 元素性質與原子(或分子)結構 |
T | 最外層電子數是次外層電子數的3倍 |
X | 常溫下單質為雙原子分子,分子中含有3對共用電子對 |
Y | M層比K層少1個電子 |
Z | 第三周期元素的簡單離子中半徑最小 |
(1)寫出元素T的原子結構示意圖 。
(2)元素Y與元素Z相比,金屬性較強的是________(用元素符號表示),下列表述中能證明這一事實的是________(填序號)。
a.Y單質的熔點比Z單質低
b.Y的化合價比Z低
c.Y單質與水反應比Z單質劇烈
d.Y最高價氧化物的水化物的堿性比Z強
(3)T、X、Y、Z中有兩種元素能形成既有離子鍵又有非極性共價鍵的化合物,寫出該化合物的電子式:_____ _________。
(4)元素T和氫元素可形成一種18電子的化合物Q,元素X與氫元素也能按原子個數比為1∶2形成一種18電子化合物W,Q與W發生氧化還原反應,生成X單質和T的另一種氫化物,寫出該反應的化學方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】微生物電池是指在微生物的作用下將化學能轉化為電能的裝置,其工作原理如圖所示。下列有關微生物電池的說法錯誤的是 ( )

A. 正極反應中有CO2生成
B. 微生物促進了反應中電子的轉移
C. 質子通過交換膜從負極區移向正極區
D. 電池總反應為C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】細胞內含有多種有機物,下圖表示細胞內有機物的元素組成和功能的關系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,x、Y、Z、P分別為構成生物大分子的基本單位。請回答下列問題:

(1)I在小麥種子中主要是指____________,I在動物細胞中主要是指____________。若物質R與I具有相似功能,并且在動物、植物細胞均含有,不僅含能量多而且體積較小,則物質R是____________。
(2)與Y相比,Z特有的成分有____________。
(3)P通過____________反應形成Ⅳ,此過程生成的H2O中H原子來自P的____________(基團)。
(4)Ⅳ結構不同的原因是____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】TiCl4是制備鈦及其化合物的重要中間體,某小組同學利用下列裝置在實驗室制備TiCl4,設計實驗如下(夾持裝置略去):

相關信息如下表所示。
化合物 | 熔點/℃ | 沸點/℃ | 密度/g·cm-3 | 水溶性 |
TiCl4 | -25 | 136 | 1.5 | 易水解生成難溶于水的物質,能溶于有機溶劑 |
CCl4 | -25 | 76.8 | 1.6 | 難溶于水 |
請回答下列問題:
(1)按照氣流由左到右的方向,上述裝置合理的連接順序為a→ → →f→g→ → →d→e→j。(填儀器接口字母)_____________
(2)根據完整的實驗裝置進行實驗,實驗步驟如下:檢查裝置氣密性后,裝入藥品;__________(按正確的順序填入下列操作的序號)。
①關閉分液漏斗活塞 ②打開分液漏斗活塞
③停止加熱,充分冷卻 ④加熱裝置D中陶瓷管
(3)裝置A中導管m的作用是________________。
(4)裝置D中除生成TiCl4外,同時生成一種氣態不成鹽氧化物,該反應的化學方程式為______________。
(5)設計實驗證明裝置E中收集到的液體中含有TiCl4:___________________________________。
(6)制得的TiCl4中常含有少量CCl4,從混合液體中分離出TiCl4的操作名稱為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸銨[(NH4)2SO4]一種優良的氮肥(俗稱肥田粉),適用于一般土壤和作物,能使枝葉生長旺盛,提高果實品質和產量,增強作物對災害的抵抗能力,可作基肥、追肥和種肥,與氫氧化鈣在加熱的條件下可以生成氨氣。根據所學知識回答下列問題:
(1)基態S原子的價電子排布式為____________,能量最高的電子所處的能層的符號為_________。
(2)SO42-空間構型為__________,中心原子的軌道雜化方式是________,寫出一個與SO42-互為等電子體的分子的化學式__________。
(3)氨氣的沸點(-33.5℃)高于硫化氫的沸點(-60.4℃)的主要原因是:_____________________________。
(4)O、N、S的第一電離能從大到小的順序是___________________。
(5)硫酸銅溶液中通入過量的氨氣會生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ鍵的個數為________。
(6)以四氯化鈦、碳化鈣、疊氮酸鹽作原料,可以生成碳氮化鈦化合物。其結構如下圖所示,這種碳氮化鈦化合物的化學式為________。若將該晶體的晶胞重新切割,使碳原子位于新晶胞的上下面心,則氮原子在新晶胞中的位置是__________________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D、E、F、G、H八種短周期主族元素,原子序數依次增大。A是所有元素中原子半徑最小的元素。B、C、D同周期且相鄰,C的氣態氫化物的水溶液顯堿性。E是同周期元素中金屬性最強的元素。F的氧化物既能溶于強酸又能溶于強堿。G的一種氧化物能使品紅溶液褪色,且G原子的M層電子數是K層電子數的3倍。按要求回答下列向題:
(1) C元素在周期表中位置_________;F原子的原子結構示意圖是________。
(2)E與D形成的化合物E2D2的電子式是_______;B與D形成的化合物BD2的結構式是_____。
(3)B、G、H三種元素最高價氧化物的水化物的酸性從強到弱的順序是________。E所在的周期中離子半徑最小的是________。(用相應酸的化學式或離子符號回答問題)
(4)G的一種氧化物能使酸性高錳酸鉀溶液褪色,對應的離子方程式_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有HCl、H2O、NH3三種物質,它們都含有1mol氫原子,則三種物質的物質的量之比為( )
A.1∶1∶1B.6∶3∶2C.3∶2∶1D.1∶2∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)根據右圖回答①②:
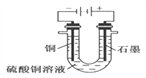
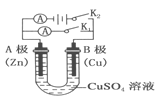
①斷開 K2,閉合 K1。B 極的電極反應式為__________。
②斷開 K1,閉合 K2。B 極的電極反應式為__________。
(2)根據右圖回答③④:
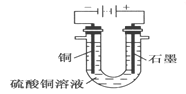
③將較純凈的CuSO4溶液放入如圖2 所示的裝置中進行電解電解反應的離子方程式為___________________。
④實驗完成后,銅電極增重a g,石墨電極產生標準狀況下的氣體體積________L。
(3)以連二硫酸根(S2O42-)為媒介,使用間接電化學法也可處理燃煤煙氣中的 NO),裝置如圖所示:
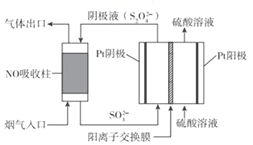
陰極區的電極反應式為_________。
(4)銀鋅堿性電池的電解質溶液為 KOH 溶液,電池放電時正極的 Ag2O2 (Ag 為+2價) 轉化為Ag ,負極的Zn轉化為K2Zn(OH)4,寫出該電池總反應方程式______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com