
| A. | 沉淀中氫氧根的質量為5.1g | B. | V為2.24L | ||
| C. | Cu的物質的量為0.1mol | D. | 反應后溶液呈中性 |
分析 反應后的溶液中加入足量氫氧化鈉溶液,金屬元素全部沉淀,得到的沉淀是Cu(OH)2和Mg(OH)2的混合物,質量增加量為沉淀中OH-的質量,計算氫氧根的物質的量,由電荷守恒可知,金屬提供電子等于沉淀中氫氧根的物質的量,采用極值法計算:假設得到的氣體全是NO,假設得到的氣體全是NO2,根據電子轉移守恒計算氣體物質的量,再計算生成氣體體積,混合氣體體積在二者之間;設混合物中Cu、Mg的物質的量分別為x、y,則根據質量可得64x+24y=5.6g,根據電子守恒可得2x+2y=0.3mol,據此計算出銅的物質的量.
解答 解:反應后的溶液中加入足量氫氧化鈉溶液,金屬元素全部沉淀,得到的沉淀是Cu(OH)2和Mg(OH)2的混合物,質量增加量為沉淀中OH-的質量,所以m(OH-)=10.7g-5.6g=5.1g,則n(OH-)=$\frac{5.1g}{17g/mol}$=0.3 mol,由電荷守恒可知,金屬提供電子等于沉淀中氫氧根的物質的量,即Cu、Mg共失去0.3 mol電子,
A.根據分析可知,沉淀中氫氧根的質量為5.1g,故A正確;
B.假設得到的氣體全是NO,由電子轉移守恒可知,n(NO)=$\frac{0.3mol}{5-2}$=0.1mol,所以NO體積是:0.1 mol×22.4 L/mol=2.24 L,
假設得到的氣體全是NO2,由電子轉移守恒可知,n(NO2)=$\frac{0.3mol}{5-4}$=0.3mol,所以NO2體積是:0.3 mol×22.4 L/mol=6.72 L,
因為得到是混合氣體,因此體積在二者之間,即2.24<V<6.72,故B錯誤;
C.設混合物中Cu、Mg的物質的量分別為x、y,則64x+24y=5.6g、2x+2y=0.3mol,解得:0.05mol、y=0.1mol,即:銅的物質的量為0.05mol,故C錯誤;
D.反應后生成硝酸鎂、硝酸銅,銅離子部分水解,溶液呈酸性,故D錯誤;
故選A.
點評 本題考查了混合物反應計算,題目難度中等,利用守恒思想計算,避免難以確定Fe反應后的價態,明確氫氧根離子所帶電荷等于金屬失去的電子為解答關鍵,試題培養了學生的化學計算能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗目的 | 實驗步驟 | |
| A | 比較CH3COOH和H2CO3酸性強弱 | 測同濃度的Na2CO3、CH3COONa溶液的pH |
| B | 比較S和Si非金屬性強弱 | 向Na2SiO3溶液中通入SO2出現渾濁 |
| C | 除去KNO3中少量NaCl | 將混合物制成熱的飽和溶液,冷卻結晶、過濾 |
| D | 探究蔗糖水解產物中是否含有葡萄糖 | 取少量水解液加入新制的氫氧化銅懸濁液并加熱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
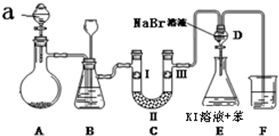
| a | b | c | d | |
| I | 干燥的有色布條 | 干燥的有色布條 | 濕潤的有色布條 | 濕潤的有色布條 |
| Ⅱ | 堿石灰 | 硅膠 | 無水氯化鈣 | 濃硫酸 |
| Ⅲ | 濕潤的有色布條 | 濕潤的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 上述灼燒過程的尾氣均可直接排到空氣中 | |
| B. | 由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2 | |
| C. | 在反應2Cu2O+Cu2S═6Cu+SO2中,作氧化劑的只有Cu2O | |
| D. | 電解精煉時,粗銅應與外電源正極相連 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化合物的名稱為2-甲基-5-乙基己烷 | |
| B. | 淀粉、纖維素、蛋白質、油脂都是高分子化合物,一定條件下都能發生水解反應 | |
| C. | 在蛋白質溶液中加入硫酸銅溶液和福爾馬林,均能使蛋白質變性,失去生理功能 | |
| D. | CH3COOCH2CH3與CH3CH2CH2COOH互為同分異構體,乙醛和苯甲醛互為同系物 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

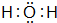 D 的原子結構示意圖
D 的原子結構示意圖 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com