
【題目】氫氣是重要的清潔能源。科學家嘗試多種方法制取氫氣。
I.(1)儲氫材料![]() 能與水反應得到氫氣。請寫出
能與水反應得到氫氣。請寫出![]() 的電子式______________,該反應的化學方程式為______________________________。
的電子式______________,該反應的化學方程式為______________________________。
Ⅱ.甘油和水蒸氣、氧氣經催化重整或部分催化氧化可制得氫氣,反應主要過程如下:
甘油水蒸氣重整( |
|
甘油部分氧化( |
|
甘油氧化水蒸汽重整( |
|
(2)反應![]() 的H1=_____ kJmol-1。
的H1=_____ kJmol-1。
(3)實際生產中將反應![]() 設定在600~700℃進行,選擇該溫度范圍的原因是:________________。
設定在600~700℃進行,選擇該溫度范圍的原因是:________________。
(4)反應![]() 的副產物很多,加入一定量的
的副產物很多,加入一定量的![]() 通入適當過量的
通入適當過量的![]() 都能提高氫氣的產率。則加入
都能提高氫氣的產率。則加入![]() 的原因:___________________;若混合氣體中,
的原因:___________________;若混合氣體中,![]() 比例過高,則
比例過高,則![]() 產率降低,其原因是:____________________________。
產率降低,其原因是:____________________________。
(5)通常將![]() 分散在高比表面的載體(
分散在高比表面的載體(![]() )上以提高催化效率。分別用三種催化劑的載體進行實驗,持續通入原料氣一段時間,繪制油轉化率與時間的關系如圖所示。
)上以提高催化效率。分別用三種催化劑的載體進行實驗,持續通入原料氣一段時間,繪制油轉化率與時間的關系如圖所示。

①結合上圖分析![]() 催化劑具有的優點是____________________。
催化劑具有的優點是____________________。
②研究發現造成催化效率隨時間下降的主要原因是副反應產生的大量碳粉(積碳)包裹催化劑,通過加入微量的、可循環利用的氧化鑭(![]() )可有效減少積碳。其反應機理包括兩步:
)可有效減少積碳。其反應機理包括兩步:
第一步為:![]()
第二步為:___________________________(寫出化學反應方程式)。
【答案】Na+[:H]- NaH+H2O=NaOH+H2↑ +128 催化劑活性和選擇性高、升高溫度反應速率加快 CaO結合CO2生成CaCO3,使反應Ⅰ平衡正向移動,H2產率提高 甘油直接燃燒不產生H2,或過量O2會與H2反應 催化效率高,穩定性高(或催化劑壽命長) La2O2CO3+C=La2O3+2CO↑
【解析】
I.(1)NaH由Na+和H-構成,電子式為Na+[:H]-,NaH與水反應,生成NaOH和H2,該反應的化學方程式為NaH+H2O=NaOH+H2↑。答案為:Na+[:H]-;NaH+H2O=NaOH+H2↑;
Ⅱ.(2)![]() H2=-1206kJmol-1 ①
H2=-1206kJmol-1 ①
![]() H3=-950kJmol-1 ②
H3=-950kJmol-1 ②
利用蓋斯定律,將(②-①)×![]() ,得
,得![]() H1=+128kJmol-1。答案為:+128;
H1=+128kJmol-1。答案為:+128;
(3)實際生產中將反應![]() 設定在600~700℃進行,選擇該溫度范圍,主要從催化劑的活性和溫度對反應速率的影響考慮,其原因是:催化劑活性和選擇性高、升高溫度反應速率加快;
設定在600~700℃進行,選擇該溫度范圍,主要從催化劑的活性和溫度對反應速率的影響考慮,其原因是:催化劑活性和選擇性高、升高溫度反應速率加快;
(4)加入CaO,可吸收產物中的CO2生成CaCO3,使反應Ⅰ平衡正向移動,H2產率提高;若混合氣體中,![]() 比例過高,則
比例過高,則![]() 產率降低,其原因是:甘油直接燃燒不產生H2,或過量O2會與H2反應。答案為:CaO結合CO2生成CaCO3,使反應Ⅰ平衡正向移動,H2產率提高;甘油直接燃燒不產生H2,或過量O2會與H2反應;
產率降低,其原因是:甘油直接燃燒不產生H2,或過量O2會與H2反應。答案為:CaO結合CO2生成CaCO3,使反應Ⅰ平衡正向移動,H2產率提高;甘油直接燃燒不產生H2,或過量O2會與H2反應;
(5)①從圖中可以看出,隨著時間的延長,其催化效率基本不變,所以![]() 催化劑具有的優點是催化效率高,穩定性高(或催化劑壽命長)。答案為:催化效率高,穩定性高(或催化劑壽命長);
催化劑具有的優點是催化效率高,穩定性高(或催化劑壽命長)。答案為:催化效率高,穩定性高(或催化劑壽命長);
②題中強調氧化鑭可循環利用,則應分解生成La2O3,反應方程式為La2O2CO3+C=La2O3+2CO↑。答案為:La2O2CO3+C=La2O3+2CO↑。


科目:高中化學 來源: 題型:
【題目】在 2A(g)+B(g)=3C(g)+4D(g)中,表示該反應最快的是( )
A.ν(A)=0.5mol/(L·s)B.ν(B)=0.3 mol/(L·s)
C.ν(C)=0.8 mol/(L·s)D.ν(D)=1 mol/(L·s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以水氯鎂石(主要成分為MgCl2·6H2O)為原料生產堿式碳酸鎂的主要流程如圖:
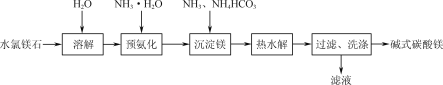
(1)為提高溶解速率,可以采取的措施有__(寫一條)。
(2)檢驗堿式碳酸鎂是否洗凈的操作為___。
(3)預氨化過程中有Mg(OH)2沉淀生成,該過程發生反應的離子方程式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T℃時,在一個體積為2L的容器中,A氣體與B氣體反應生成C氣體,反應過程中A、B、C變化如圖所示。
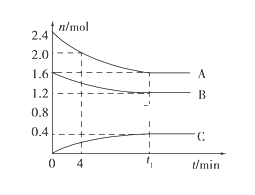
(1)寫出該反應的化學方程式:___________;
(2)該溫度下該反應的平衡常數為(保留兩位有效數字)_______;
(3)已知:K(300℃)>K(350℃),該反應是________熱反應;
(4)0~4分鐘時,A的平均反應速率為____________;
(5)到達平衡時B的轉化率為____________;
(6)恒容條件下,下列措施中能使![]() 降低的有__________。
降低的有__________。
A 充入氦氣 B 使用催化劑
C 再充入2.4mol A和1.6mol B D 降低溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】超臨界狀態下的CO2流體溶解性與有機溶劑相似,可提取中藥材的有效成分,工藝流程如下。
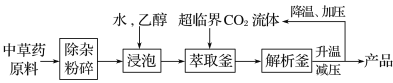
下列說法中錯誤的是( )
A.浸泡時加入乙醇有利于中草藥有效成分的浸出
B.高溫條件下更有利于超臨界CO2流體萃取
C.升溫、減壓的目的是實現CO2與產品分離
D.超臨界CO2流體萃取中藥材具有無溶劑殘留、綠色環保等優點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】枸櫞酸( )是一種弱有機酸,是柑橘類水果中產生的一種天然防腐劑,也是食物和飲料中的酸味添加劑。
)是一種弱有機酸,是柑橘類水果中產生的一種天然防腐劑,也是食物和飲料中的酸味添加劑。
(1)枸櫞酸屬于____(填“無機化合物”或“有機化合物”)。
(2)枸櫞酸中含氧官能團有羧基和____(填名稱)。
(3)向枸櫞酸溶液中滴入2~3滴紫色石蕊試液,溶液顏色變紅,說明枸櫞酸溶液具有____性。
(4)1 mol枸櫞酸最多消耗____mol NaOH。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D四種短周期元素,它們的原子序數由A到D依次增大,已知A原子和B原子有相同的電子層數,且A的L層電子數是K層電子數的兩倍,C在空氣中燃燒時呈現黃色火焰,C的單質在加熱下與足量的B的單質充分反應,可以得到與D單質顏色相同的淡黃色固態化合物。試根據以上敘述回答:
(1)元素名稱:A_____,B______,C_______。
(2)D元素位于周期表中第_____周期_____族,它的最高價氧化物對應的水化物的化學式是_____________________。
(3)寫出AB2與C2B2反應的化學方程式:____________。
(4)寫出A單質與D元素的最高價氧化物對應水化物的濃溶液共熱反應的化學方程式:___。若要設計實驗驗證該反應產物,則驗證的產物順序是_______(填寫產物的化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某科研團隊研究將磷鎢酸(H3PW12O40,以下簡稱HPW)代替濃硫酸作為酯化反應的催化劑,但HPW自身存在比表面積小、易溶于有機溶劑而難以重復使用等缺點,將其負載在多孔載體(如硅藻土、C等)上則能有效克服以上不足,提高其催化活性。用HPW負載在硅藻土上催化制取乙酸正丁酯的酯化率與HPW負載量的關系(溫度:120℃,時間:2h)如圖所示,下列說法不正確的是
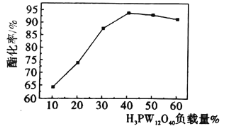
A.與HPW相比,HPW/硅藻土比表面積顯著增加,有助于提高其催化性能
B.當HPW負載量為40%時達到飽和,酯化率最高
C.用HPW/硅藻土代替傳統催化劑,可減少設備腐蝕等不足
D.不同催化劑對酯化率的影響程度主要取決于化學反應正向進行的程度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的兩種或多種組成,現對該混合物做如下實驗,所得現象和有關數據如圖所示(氣體體積數據已換算成標準狀況下的體積)。關于該固體混合物,下列說法正確的是

A. 一定含有Al,其質量為4.05g
B. 一定不含FeCl2,可能含有MgCl2和AlCl3
C. 一定含有MgCl2 和FeCl2
D. 一定含有(NH4)2SO4 和MgCl2,且物質的量相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com