
| X | Y | ||
| Z | W |
| A. | X、Y、Z、W四種元素均為非金屬元素 | |
| B. | Y、W的最簡單氫化物中,Y的沸點高 | |
| C. | X、Y、Z、W最高價氧化物均為共價化合物 | |
| D. | W元素的簡單離子半徑小于Z元素的簡單離子半徑 |
分析 Y、Z質子數之和為21,由元素在周期表中的位置可知,X、Y、Z、W應為二、三周期元素,設Y的質子數為x,則X的質子數為x-2,W的質子數為x+8,Z的質子數為x+5,根據Y、Z質子數之和為21可得:x+x+5=21,解得:x=8,可推出Y為O元素,則X為C元素;Z為鋁元素,W為硫元素,據此解答.
A.Z為鋁元素,鋁屬于金屬元素;
B.水分子間存在氫鍵,水的沸點較高;
C.氧化鋁為離子化合物;
D.離子的電子層越多,離子半徑越大,硫離子比鋁離子多1個電子層.
解答 解:Y、Z質子數之和為21,由元素在周期表中的位置可知,X、Y、Z、W應為二、三周期元素,設Y的質子數為x,則X的質子數為x-2,W的質子數為x+8,Z的質子數為x+5,根據Y、Z質子數之和為21可得:x+x+5=21,解得:x=8,可推出Y為O元素,則X為C元素;Z為鋁元素,W為硫元素,
A.C、O、S為非金屬元素,而Al為金屬元素,故A錯誤;
B.硫化氫常溫下為氣體,水分子之間存在氫鍵,常溫下為液體,沸點較高,故B正確;
C.鋁的最高價氧化物為氧化鋁,氧化鋁為離子化合物,故C錯誤;
D.W為S元素,其離子為硫離子,Z元素為鋁,鋁離子核外電子層數為2,硫離子的含有3個電子層,則硫離子半徑大于鋁離子,故D錯誤;
故選B.
點評 本題考查元素周期表和元素周期律的綜合應用,題目難度中等,根據X、W質子數之和為22確定在周期表中所處的周期是關鍵,注意熟練掌握元素周期表結構、元素周期律內容.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
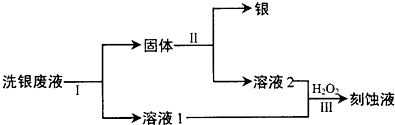
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同種元素的質子數必定相同 | |
| B. | 元素的化學性質主要決定于原子的最外層電子數 | |
| C. | 原子核都是由質子和中子構成的 | |
| D. | 元素性質呈現周期性變化的根本原因是核外電子排布呈周期性變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
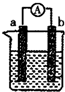 如圖是某化學興趣小組探究不同條件下化學能轉變為電能的裝置.
如圖是某化學興趣小組探究不同條件下化學能轉變為電能的裝置.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 廢易拉罐--可回收物 | B. | 廢塑料瓶--其他垃圾 | ||
| C. | 廢熒光燈管--有害垃圾 | D. | 不可再生廢紙--可燃垃圾 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
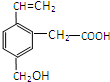 某有機物的結構如圖所示,這種有機物不可能具有的性質是
某有機物的結構如圖所示,這種有機物不可能具有的性質是| A. | ①④ | B. | 只有⑥ | C. | 只有③ | D. | ④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同 | B. | 中和HCl的多 | C. | 中和CH3COOH的多 | D. | 無法比較 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 0-6min的平均反應速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6-10min的平均反應速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反應到6min時,H2O2分解了50% | |
| D. | 反應到6min時,c(H2O2)=0.30mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com