

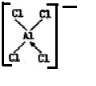
 ,[AlCl4]的立體構型名稱為正四面體形.
,[AlCl4]的立體構型名稱為正四面體形.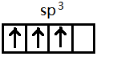 ,鈹與鋁元素性質相近的原因是Be與Al的電負性相近.
,鈹與鋁元素性質相近的原因是Be與Al的電負性相近.分析 (1)①根據氯化鈹的結構圖可知,鈹原子周圍有四個共價鍵,提供四個用于成鍵的軌道;[AlCl4]的結構中,每個鋁原子和四個氯原子形成共價鍵,且其中一個共用電子對是氯原子提供形成的配位鍵;根據雜化軌道了理論判斷[AlCl4]的立體構型;
②在[AlCl4]中,鋁原子價電子為sp3雜化,據此書寫排布圖,有些元素的化學性質和它在周期表中左上方或右下方另一主族元素電負性相近,性質相似,據此分析鈹與鋁元素性質相近的原因;
(2)氣態原子或氣態離子失去一個電子所需要的最小能量稱為元素的電離能,同周期自左而右元素的第一電離能呈增大趨勢,但ⅡA族最外層為ns能級容納2個電子,為全滿確定狀態,能量較低,第一電離能高于同周期相鄰元素,一般失去一個電子為第一電離能,以此類推;
(3)碳酸鹽分解的本質為CO32-生成CO2和O2-,離子半徑越小,離子鍵越強,晶格能越大,熱穩定性越好;
(4)晶體熔點較高容易在巖漿冷卻過程中先結晶,晶格能越大,離子鍵越強,熔點越高;
(5)鎂晶體的堆積方式為ABA型,屬于六方最密堆積,積方式的空間利用率為=$\frac{V球}{V晶胞}$,據此計算空間利用率.
解答 解:(1)?根據氯化鈹的結構圖可知,鈹原子周圍有四個共價鍵(其中有兩個是配位鍵),所以要進行sp3雜化,從而提供四個用于成鍵的軌道,鋁原子最外層電子只有3個電子,形成3個共價鍵,[AlCl4]的結構中,每個鋁原子和四個氯原子形成共價鍵,且其中一個共用電子對是氯原子提供形成的配位鍵,結構式為: ,中心原子Al的價層電子對數4,雜化類型為sp3,立體構型為:正四面體形,
,中心原子Al的價層電子對數4,雜化類型為sp3,立體構型為:正四面體形,
故答案為:sp3;  ;正四面體形;
;正四面體形;
?②鋁位于周期表中第三周期第IIIA,其核外電子排布式為1s22s22p63s23p1或[Ne]3s23p1,在[AlCl4]中,結構式為: ,中心原子Al的價層電子對數4,雜化類型為sp3,所以價電子在雜化軌道中的排布圖為
,中心原子Al的價層電子對數4,雜化類型為sp3,所以價電子在雜化軌道中的排布圖為 ,Al與Be在周期表中處對角線,電負性相近,性質相似,與強酸、強堿均反應,
,Al與Be在周期表中處對角線,電負性相近,性質相似,與強酸、強堿均反應,
故答案為: ; Be與Al的電負性相近;
; Be與Al的電負性相近;
(2)A.鎂的電離能為I1、I2、I3…,失去第一個電子比第二個電子需能量低,以此類推,所以I1<I2<I3<I4,故A正確;
B.由I3+I2<I2+I1 可知I3<I1,與失去第一個電子比第三個電子需能量低矛盾,故B錯誤;
C.同周期從左到右第一電離能依次增大,但鎂,鋁特殊,理由是鎂的價電子排布是3s2,3p軌道全空較穩定,而鋁是3s23p1則不是全滿,全空,半空中任意一種情況,不穩定,故鋁的第一電離能比鎂小,所以I2-I1′<I2-I1,故C正確;
D.鋁的第一電離能比鎂小,所以I1′<I1,3p軌道全空較穩定,所以I2′>I2,故D正確;
故答案為:B;
(3)碳酸鹽分解的本質為CO32-生成CO2和O2-,O2-與金屬陽離子結合的過程,MgO、CaO、SrO、BaO,陽離子相同,鎂離子半徑最小,MgO晶格能最大最穩定,故MgCO3最易分解(或離子晶體中陽離子的半徑越小,結合碳酸根中的氧離子越容易),所以MgCO3、CaCO3、SrCO3、BaCO3的熱穩定性有強到弱的順序為BaCO3>SrCO3>CaCO3>MgCO3,
故答案為:BaCO3>SrCO3>CaCO3>MgCO3;碳酸鹽分解的本質為CO32-生成CO2和O2-,O2-與金屬陽離子結合的過程,而MgO晶格能最大最穩定,故MgCO3最易分解(或離子晶體中陽離子的半徑越小,結合碳酸根中的氧離子越容易);
(4)MgSiO3、CaSiO3、SrSiO3、BaSiO3都為離子晶體,陰離子相同,都為SiO32-,陽離子半徑:Mg 2+<Ca2+<Sr2+<Ba2+,所以晶格能MgSiO3>CaSiO3>SrSiO3>BaSiO3,晶體熔點較高容易在巖漿冷卻過程中先結晶,所以巖漿中MgSiO3、CaSiO3、SrSiO3、BaSiO3晶出的先后順序為:MgSiO3>CaSiO3>SrSiO3>BaSiO3,
故答案為:MgSiO3>CaSiO3>SrSiO3>BaSiO3;
(5)鎂晶體的堆積方式為ABA型,屬于六方最密堆積,設平行六邊形各邊長為a=2r,如圖: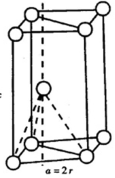 ,平行四邊形的面積s=a×asin60°=$\frac{\sqrt{3}}{2}$a2,h=2×邊長為a的四面體的高=2×$\frac{\sqrt{6}}{3}$a=$\frac{2\sqrt{6}}{3}$a,V晶胞=Sh=$\frac{\sqrt{3}}{2}$a2×$\frac{2\sqrt{6}}{3}$a=$\sqrt{2}$a3=8$\sqrt{2}$r3,V球=2×$\frac{4}{3}$×π×r3,該堆積方式的空間利用率為=$\frac{V球}{V晶胞}$=$\frac{\sqrt{2}π}{6}$,
,平行四邊形的面積s=a×asin60°=$\frac{\sqrt{3}}{2}$a2,h=2×邊長為a的四面體的高=2×$\frac{\sqrt{6}}{3}$a=$\frac{2\sqrt{6}}{3}$a,V晶胞=Sh=$\frac{\sqrt{3}}{2}$a2×$\frac{2\sqrt{6}}{3}$a=$\sqrt{2}$a3=8$\sqrt{2}$r3,V球=2×$\frac{4}{3}$×π×r3,該堆積方式的空間利用率為=$\frac{V球}{V晶胞}$=$\frac{\sqrt{2}π}{6}$,
故答案為:$\frac{\sqrt{2}π}{6}$.
點評 本題考查了金屬晶體結構,題目難度中等,注意掌握典型晶體晶胞結構,明確堆積方式的空間利用率的含義是解答(5)關鍵,為學習的難點,雜化理論是物質結構學習的重點.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
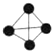 ),已知斷裂1molN-N吸收167kJ熱量,生成1molN≡N放出942kJ熱量,根據以上信息和數據,下列說法正確的是( )
),已知斷裂1molN-N吸收167kJ熱量,生成1molN≡N放出942kJ熱量,根據以上信息和數據,下列說法正確的是( )| A. | 1molN4氣體完全轉變為N2將放出882kJ熱量 | |
| B. | 14N2與15N2互為同位素,N4與N2互為同素異形體 | |
| C. | N4屬于一種新型的化合物 | |
| D. | 14N與15N化學性質不相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 改變溫度和使用催化劑都能改變化學反應速率 | |
| B. | 利用丁達爾效應可以區別FeCl3溶液和Fe(OH)3膠體 | |
| C. | 根據△G=△H-T△S推測:△H<0的化學反應都可以自發進行 | |
| D. | 將AlCl3溶液蒸干并灼燒,所得固體為Al2O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 粉身碎骨渾不怕,要留清白在人間 | B. | 曾青得鐵則化為銅 | ||
| C. | 春蠶到死絲方盡,蠟炬成灰淚始干 | D. | 水滴石穿 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蛋白質屬于天然有機高分子化合物,沒有蛋白質就沒有生命 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白質變性 | |
| C. | 某些蛋白質跟濃硝酸作用會變黃 | |
| D. | 可以采用多次鹽析或多次滲析的方法分離、提純蛋白質 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 ,Q3Y2與水可劇烈反應,產生沉淀與氣體,反應的化學方程式為Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
,Q3Y2與水可劇烈反應,產生沉淀與氣體,反應的化學方程式為Mg3N2+6H2O=3Mg(OH)2+2NH3↑.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
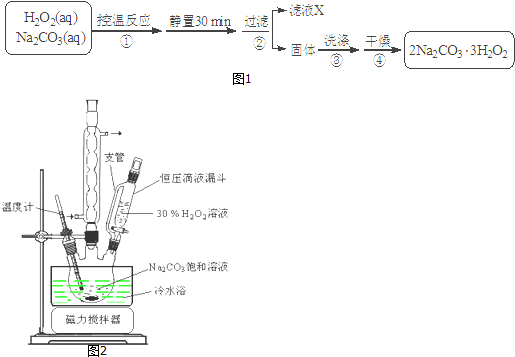
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com