
【題目】X、Y、Z、W 是短周期主族元素,X 原子最外層電子數是其內層電子數的 3 倍;Y 的原子序數是其最外層電子數的 6 倍;Z 的一種單質是自然界中最硬的物質;自然界中,W 的單質多出現在火山口附近,且為淡黃色晶體。下列敘述正確的是
A. 原子半徑的大小:Z>X > Y
B. W 的氫化物的沸點比 X 的高
C. Y 的單質可通過鋁熱反應冶煉
D. W 的最高價氧化物對應水化物的酸性在同主族中最強
【答案】D
【解析】
X、Y、Z、W是短周期主族元素,X原子最外層電子數是其內層電子數的3倍,X為O元素;Y的原子序數是其最外層電子數的6倍,則Y的最外層電子數為2,原子序數為12,即Y為Mg元素;Z的一種單質是自然界中最硬的物質,Z為C元素;自然界中,W的單質多出現在火山口附近,且為淡黃色晶體,W為S,以此來解答。
A.電子層越多,原子半徑越大,同周期從左向右原子半徑減小,則原子半徑的大小:Y![]() Z
Z![]() X,故A錯誤;;
X,故A錯誤;;
B.W的氫化物是H2S,X的氫化物是H2O,因為H2O分子間有氫鍵,所以H2O的沸點比H2S的沸點高,故B錯誤;
C.鋁熱反應用于冶煉高熔點金屬,比如釩,鉻,錳,鎢,不能冶煉比鋁活潑的,比如鎂,故C錯誤;
D.W的最高價氧化物對應水化物為硫酸,最高價氧化物對應水化物的酸性在同主族中最強,故D正確;
本題答案為D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】某學生通過測定反應過程中所放出的熱量來計算中和熱。他將50mL0.5mol/L 的鹽酸與50mL0.55mol/L 的 NaOH 溶液在如圖所示的裝置中進行中和反應。 請回答下列問題:
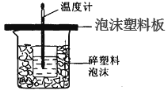
(1)從實驗裝置上看,圖中尚缺少的一種玻璃用品是_________;由圖可知該裝 置有不妥之處,應如何改正?_____。
(2)實驗中改用 60 mL0.50 mol/L 的鹽酸跟 50mL 0.55 mol/L 的 NaOH 溶液進行反應,與 上述實驗相比,所放出的熱量_____(填“相等”或“不相等”);所求中和熱的數值會_____(填“相等”或 “不相等”),理由是_____。
(3)該同學做實驗時有些操作不規范,造成測得中和熱的數值偏低,請你分析可能的原因 是_____。
A.測量鹽酸的溫度后,溫度計沒有用水沖洗干凈 B.把量筒中的氫氧化鈉溶液倒入小燒杯時動作遲緩 C.做本實驗的當天室溫較高 D.在量取鹽酸時仰視計數
E.將 50mL0.55mol/L 氫氧化鈉溶液取成了 50mL0.55mol/L 的氨水
(4)將 V1ml 1.0mol/L HCl 溶液和 V2ml 未知濃度的 NaOH 溶液混合均勻后測量并記錄溫 度,實驗結果如下圖所示(實驗中始終保持 V1+V2=50mL)
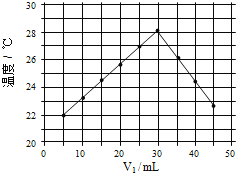
通過分析圖像可知,做該實驗時環境溫度_____(填“高于”,“低于”或“等于”)22℃,該 NaOH 溶液的濃度約為_____mol/L。
(5)假設鹽酸和氫氧化鈉溶液的密度都是 1g·cm-3,又知中和反應后生成溶液的比熱容 c=4.18J·g-1·℃-1。為了計算中和熱,某學生實驗記錄數據如下:
實驗序號 | 起始溫度 t1/℃ | 終止溫度 t2/℃ | |
鹽酸 | 氫氧化鈉溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依據該學生的實驗數據計算,該實驗測得的中和熱ΔH=_____(結果保留一位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水開發利用的部分過程如圖所示。下列說法錯誤的是( )
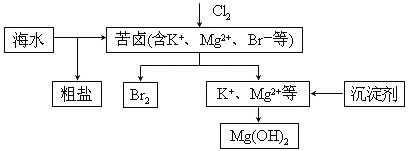
A. 向苦鹵中通入Cl2是為了提取溴
B. 工業生產中常選用NaOH作為沉淀劑
C. 粗鹽可采用除雜和重結晶等過程提純
D. 富集溴一般先用空氣和水蒸氣吹出單質溴,再用![]() 將其還原吸收
將其還原吸收
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知2A2(g)+B2(g)![]() 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一個有催化劑的容積不變的密閉容器中加入2 molA2和1 molB2,在500℃時充分反應,達平衡后C3的濃度為w mol·L-1,放出熱量為Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一個有催化劑的容積不變的密閉容器中加入2 molA2和1 molB2,在500℃時充分反應,達平衡后C3的濃度為w mol·L-1,放出熱量為Q2 kJ。
(1)達到平衡時, A2的轉化率為____________。
(2)達到平衡后,若向原容器中通入少量的氬氣,A2的轉化率將________(填“增大“、“減小”或“不變”)
(3)若在原來的容器中,只加入2mol C3,500℃時充分反應達平衡后,吸收熱量Q3 kJ,C3濃度___(填>、=、<)w mol·L-1,Q1、Q2、Q3 之間滿足何種關系:Q3=____________。

(4)改變某一條件,得到如圖的變化規律(圖中T表示溫度,n表示物質的量),可得出的結論正確的是____________;
a.反應速率c>b>a
b.達到平衡時A2的轉化率大小為:b>a>c
c.T2>T1
d.b點A2和B2的物質的量之比為2:1
(5)若將上述容器改為恒壓容容器,起始時加入4 molA2和2 molB2,500℃時充分反應達平衡后,放出熱量Q4 kJ,則Q2__________Q4(填“>”、“<”或“=”)。
(6)下列措施可以同時提高反應速率和B2的轉化率是___________(填選項序號)。
a.選擇適當的催化劑 b.增大壓強
c.及時分離生成的C3 d.升高溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】意大利羅馬大學的Fulvio Cacace等人獲得了極具理論研究意義的N4分子。N4分子結構如右圖,已知斷裂1mol N≡N鍵吸收942kJ熱量,生成1molN-N鍵釋放167kJ熱量根據以上信息和數據,下列熱化學方程式正確的是
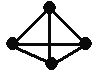
A. 2N2 = N4 △H = -882kJ·mol-1
B. N2 (g) = 0.5N4 (g) △H = +441kJ
C. N2 (g) = 0.5N4 (g) △H = -441kJ·mol-1
D. 2N2(g) = N4(g) △H = +882 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖象能正確表示相關反應中產物物質的量的變化的是(橫、縱坐標單位:mol)
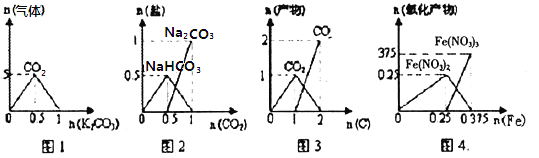
A. 圖l:n(HCl)=lmol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的氣體
B. 圖2:n(NaOH)="1" mol,CO2逐步通人到NaOH溶液中反應生成的鹽
C. 圖3:n(O2)=1mol,高溫下C和O2在密閉容器中的反應產物
D. 圖4:n(HNO3,)=lmol,Fe和稀HNO3反應生成的氧化產物(還原產物為NO)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學中常用圖像直觀地描述化學反應的進程或結果。下列圖像描述正確的是

A. 圖①表示不同壓強對可逆反應2A(g)+2B(g)![]() 3C(g)+D(s)的影響
3C(g)+D(s)的影響
B. 圖②表示向10ml0.1mol·L-1Na2CO3和NaHCO3兩種溶液中分別滴加0.lnol·L-1HCl溶液時,CO2的體積隨鹽酸體積的變化,則b表示的是NaHCO3溶液
C. 圖③表示體積和pH均相同的HCl、CH3COOH兩種溶液中,分別加入足量的鋅,產生H2的體積隨時間的變化,則a表示的是HCl溶液
D. 圖④表示該反應為放熱反應,且催化劑能改變反應的焓變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com