
| A. | 等濃度等體積H2A與NaOH的混合溶液呈堿性 | |
| B. | H2A與少量B2-反應的離子方程式為2H2A+B2-=2HA-+H2B | |
| C. | NaHB溶液一定顯酸性 | |
| D. | 等濃度等體積的NaHA與Na2B混合,混合溶液中存在這樣的關系:c(A2-)>c(B2-)>c(HA-)>c(HB-) |
分析 A.等濃度等體積H2A與NaOH的混合得到NaHA溶液,溶液HA-水解程度和電離程度大小不知不能判斷溶液酸堿性;
B.結合酸性強弱順序H2A>H2B>HA->HB-分析判斷反應是否進行;
C.NaHB溶液中HB-離子的電離和水解程度不知不能確定溶液酸堿性;
D.等濃度等體積NaHA 與Na2B 的混合溶液中c(A2-)<c(B2-);
解答 解:A.等濃度等體積H2A與NaOH的混合,得到NaHA溶液,溶液HA-水解程度和電離程度大小不知溶液不一定呈堿性,故A錯誤;
B.酸性強弱順序H2A>H2B>HA->HB-,H2A與少量B2-反應的離子方程式為2H2A+B2-=2HA-+H2B,故B正確;
C.NaHB溶液中HB-離子電離程和水解程度大小不知不能確定溶液酸堿性,故C錯誤;
D.酸性強弱順序H2A>H2B>HA->HB-,等濃度等體積NaHA 與Na2B 的混合溶液中c(A2-)<c(B2-),故D錯誤;
故選B.
點評 本題考查了弱電解質電離平衡的分析應用,主要是鹽類水解和對應酸的酸性強弱應用,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將40gNaOH固體溶解于1L水中 | |
| B. | 將22.4L氯化氫氣體溶于水配成1L溶液 | |
| C. | 將1L 10 mol/L的濃鹽酸與9L水混合 | |
| D. | 將10gNaOH溶解在少量水中,再加蒸餾水直到溶液體積為250mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑥⑦⑨ | D. | ③⑤⑦⑨ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

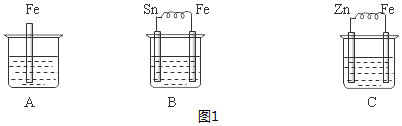
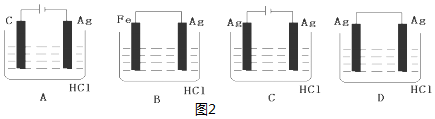
| A. | 甲中負極反應式為Ag++e-═Ag | |
| B. | 丙中H+向碳棒方向移動 | |
| C. | 乙中陽極反應式為2H++2e-═H2↑ | |
| D. | 丁中電解開始時陽極產生黃綠色氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com