
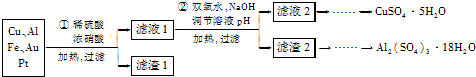
分析 本題是以含70%Cu、25%Al、4%Fe及少量Au、Pt等金屬的混合物制備硫酸銅和硫酸鋁晶體的流程,首先在稀硫酸、濃硝酸混合酸后加熱,Cu、Al、Fe發生反應生成Cu2+、Al3+、Fe2+,過濾除去少量Au、Pt;在濾液1中用綠色氧化劑過氧化氫氧化二價鐵離子得到三價鐵,然后通過調整溶液的pH使Fe3+、Al3+沉淀,過濾得到濾液2結晶,得到硫酸銅晶體,濾渣2為氫氧化鐵和氫氧化鋁的混合物,先用氫氧化鈉溶液溶解氫氧化鋁沉淀,過濾得到偏鋁酸鈉溶液,再通人二氧化碳至不再有沉淀析出,過濾、用水洗滌固體2-3次得純凈的氫氧化鋁沉淀,將固體轉移到燒杯中,用硫酸溶解,蒸發濃縮、冷卻結晶,得到硫酸鋁晶體,
(1)稀硫酸、濃硝酸混合酸后加熱,Cu與濃硝酸發生反應生成Cu2+、NO2和H2O;
(2)過氧化氫具有氧化性且被還原為水,無雜質無污染,可以氧化亞鐵離子為鐵離子易于沉淀除去;
(3)①有碘參加反應,因此可以選用淀粉溶液作指示劑,根據滴定終點的判斷方法分析;
②CuSO4溶液與KI反應,銅離子被I-還原為亞銅離子,碘離子被氧化為I2,據此書寫離子方程式;
③根據方程式可知20.00mL溶液中n(CuSO4•5H2O)=n(EDTA)=c×6×10-3mol結合w=$\frac{m(CuSO{\;}_{4}•5H{\;}_{2}O)}{m(總)}$×100%計算;
(4)根據以上分析,濾渣2為氫氧化鐵和氫氧化鋁的混合物,先用氫氧化鈉溶液溶解氫氧化鋁沉淀,過濾得到偏鋁酸鈉溶液,再通人二氧化碳至不再有沉淀析出,過濾、用水洗滌固體2-3次得純凈的氫氧化鋁沉淀,將固體轉移到燒杯中,用硫酸溶解,蒸發濃縮、冷卻結晶,得到硫酸鋁晶體;
解答 解:本題是以含70%Cu、25%Al、4%Fe及少量Au、Pt等金屬的混合物制備硫酸銅和硫酸鋁晶體的流程,首先在稀硫酸、濃硝酸混合酸后加熱,Cu、Al、Fe發生反應生成Cu2+、Al3+、Fe2+,過濾除去少量Au、Pt;在濾液1中用綠色氧化劑過氧化氫氧化二價鐵離子得到三價鐵,然后通過調整溶液的pH使Fe3+、Al3+沉淀,過濾得到濾液2結晶,得到硫酸銅晶體,濾渣2為氫氧化鐵和氫氧化鋁的混合物,先用氫氧化鈉溶液溶解氫氧化鋁沉淀,過濾得到偏鋁酸鈉溶液,再通人二氧化碳至不再有沉淀析出,過濾、用水洗滌固體2-3次得純凈的氫氧化鋁沉淀,將固體轉移到燒杯中,用硫酸溶解,蒸發濃縮、冷卻結晶,得到硫酸鋁晶體,
(1)稀硫酸、濃硝酸混合酸后加熱,Cu與濃硝酸發生反應生成Cu2+、NO2和H2O,離子反應為:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;故答案為:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)雙氧水作氧化劑把Fe2+氧化為Fe3+;故答案為:把Fe2+氧化為Fe3+;
(3)①有碘參加反應,因此可以選用淀粉溶液作指示劑,根據滴定終點的判斷方法,要求藍色剛好褪去,且半分鐘內不恢復藍色;故答案為:淀粉溶液;藍色剛好褪去,且半分鐘內不恢復藍色;
②銅離子被I-還原為亞銅離子,碘離子被氧化為I2,根據原子守恒和得失電子守恒書寫離子方程式為;2Cu2++4I-═2CuI↓+I2;故答案為:2Cu2++4I-═2CuI↓+I2;
③根據方程式可知20.00mL溶液中n(CuSO4•5H2O)=n(EDTA)=c×6×10-3mol;所以m(CuSO4•5H2O)=c×6×10-3mol×250g/mol=1.5c g,因此100mL溶液中CuSO4•5H2O的質量為:1.5c×5=7.5cg,所以w=$\frac{7.5cg}{ag}$×100%=$\frac{7.5c}{a}$×100%,故答案為:$\frac{7.5c}{a}$×100%;
(4)根據以上分析,濾渣2為氫氧化鐵和氫氧化鋁的混合物,先用氫氧化鈉溶液溶解氫氧化鋁沉淀,過濾得到偏鋁酸鈉溶液,再通人二氧化碳至不再有沉淀析出,過濾、用水洗滌固體2-3次得純凈的氫氧化鋁沉淀,將固體轉移到燒杯中,用硫酸溶解,蒸發濃縮、冷卻結晶,得到硫酸鋁晶體;故答案為:氫氧化鈉溶液;通人二氧化碳至不再有沉淀析出,過濾、用水洗滌固體2-3次,將固體轉移到燒杯中,用硫酸溶解,蒸發濃縮、冷卻結晶.
點評 本題考查離子分離的方法,實驗設計,試劑選擇,中和滴定的簡單計算和誤差的分析,離子性質的熟練掌握是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
 “低碳循環”引起各國的高度重視,已知煤、甲烷等可以與水蒸氣反應生成以CO和H2為主的合成氣,合成氣有廣泛應用.試回答下列問題:
“低碳循環”引起各國的高度重視,已知煤、甲烷等可以與水蒸氣反應生成以CO和H2為主的合成氣,合成氣有廣泛應用.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 磷酸的摩爾質量(以g/mol為單位)與NA 個磷酸分子的質量(以g為單位)在數值上相等 | |
| B. | NA個氮分子和NA個氫分子的質量比等于14:1 | |
| C. | 1 mol CH3+(碳正離子)中含有電子數為10 NA | |
| D. | 32g氧氣所含的氧原子數目為2 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 成份 | 濃度/(mol•L-1) | 質量分數 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,23gNO2與N2O4的混合物中含有NA個氧原子 | |
| B. | 一定條件下,1.4g N2和0.2mol H2混合充分反應,轉移的電子數為0.3NA | |
| C. | 標準狀況下,40g三氧化硫體積約為11.2L | |
| D. | 1L1mol•L?1的Na2CO3 溶液中陰離子數目小于NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L 氟化氫中含2NA個原子 | |
| B. | 0.1mol/L的Na2CO3溶液含有CO32-的數目為0.1NA | |
| C. | 6.0g金剛石含有C-C鍵的數目為NA | |
| D. | 氫氧燃料電池正極消耗22.4 L氣體時,電路中通過電子的數目為4 NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com