
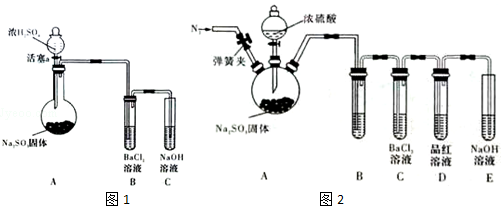
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 發生裝置 |  |  |  |  |
| 所選試劑 | NaHSO3固體 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
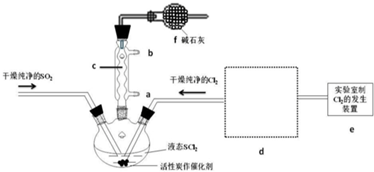
分析 (1)由圖可知儀器,堿石灰與氣體反應;
(2)SOCl2與水反應的方程式為:SOCl2+H2O=SO2↑+2HCl↑,AlCl3溶液易水解,AlCl3•6H2O與SOCl2混合加熱,SOCl2與AlCl3•6H2O中的結晶水作用,生成無水AlCl3及SO2和HCl氣體,SOCl2吸水,產物SO2和HCl溶于水呈酸性抑制水解發生;
(3)丁中固體與液體反應制取二氧化硫比較合理,制取氣體需要純凈,操作簡單;
(4)裝置e中產生的Cl2經過d后進入三頸燒瓶,d干燥氯氣,且除去HCl;
(5)已知氯化亞砜沸點為77℃,已知SCl2的沸點為50℃,所以采用分餾的方法即可將之分離;消耗氯氣為$\frac{0.896L}{22.4L/mol}$=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2.
解答 解:(1)儀器c是球形冷凝管,f有兩個作用一個是防止有毒的氯氣與二氧化硫逸出對實驗人員的身體健康造成威脅,一個是防止空氣中的水蒸氣進入燒瓶中使氯化亞砜水解,
故答案為:球形冷凝管;吸收逸出有毒的Cl2、SO2,防止空氣中的水蒸氣進入反應裝置,防止SOCl2水解;
(2)SOCl2與水反應的方程式為:SOCl2+H2O=SO2↑+2HCl↑,AlCl3溶液易水解,AlCl3•6H2O與SOCl2混合加熱,SOCl2與AlCl3•6H2O中的結晶水作用,生成無水AlCl3及SO2和HCl氣體,SOCl2吸水,產物SO2和HCl溶于水呈酸性抑制水解發生,
故答案為:SOCl2+H2O=SO2↑+2HCl↑;AlCl3溶液易水解,AlCl3•6H2O與SOCl2混合加熱,SOCl2與AlCl3•6H2O中的結晶水作用,生成無水AlCl3及SO2和HCl氣體,SOCl2吸水,產物SO2和HCl抑制AlCl3水解;
(3)甲中加熱亞硫酸氫鈉確實會產生二氧化硫,但是同時也會生成較多的水蒸汽,故甲不選;
乙中18.4mol/L的硫酸太濃,其中水分過少硫酸仍然以分子形式存在,無法與銅反應制取二氧化硫,故乙不選;
丙中無論是濃硝酸還是稀硝酸都具有很強的氧化性,可以輕易的將亞硫酸鈉中的正4價的硫氧化為正6價的硫酸根離子而無法得到二氧化硫,故丙不選;
丁中反應生成硫酸鉀與二氧化硫還有水,丁制取二氧化硫比較合理,
故答案為:丁;
(4)裝置e中產生的Cl2經過d后進入三頸燒瓶,d干燥氯氣,且除去HCl,則d的虛線框內畫出所需實驗裝置圖,并標出試劑為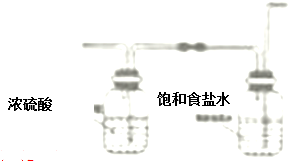 ,
,
故答案為: ;
;
(5)已知氯化亞砜沸點為77℃,已知SCl2的沸點為50℃,所以采用分餾的方法即可將之分離;消耗氯氣為$\frac{0.896L}{22.4L/mol}$=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,則SOCl2的產率為$\frac{4.76g}{0.08mol×119g/mol}$×100%=50%,
故答案為:蒸餾;50%.
點評 本題考查物質的制備實驗,把握制備實驗及發生的反應為解答的關鍵,側重于學生的分析能力和實驗能力的考查,注意常見氣體的制備原理及應用,注意題干信息的正確獲取和靈活應用,題目難度不大.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 苯甲醛(
苯甲醛(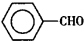 )、苯甲酸(
)、苯甲酸(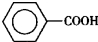 )都是重要的化工原料,都可用甲苯(
)都是重要的化工原料,都可用甲苯(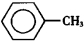 )為原料生產.下表列出了有關物質的部分物理性質,請回答:
)為原料生產.下表列出了有關物質的部分物理性質,請回答:| 名稱 | 性狀 | 熔點(℃) | 沸點(℃) | 相對密度 ρ水=1g/cm3 | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 無色液體易燃易揮發 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 無色液體 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片狀或針狀晶體 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
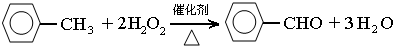 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
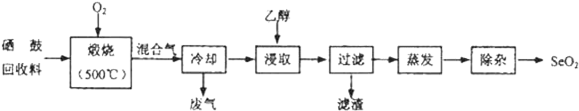
| 物質 | 熔點 | 沸點 | 溶解度 |
| SeO2 | 340℃(315℃升華) | 684℃ | 易溶于水和乙醇 |
| TeO2 | 733℃(450℃升華) | 1260℃ | 微溶于水,不溶于乙醇 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
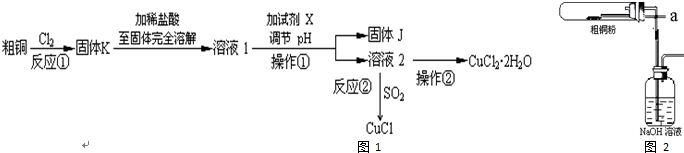
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
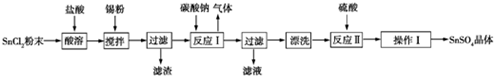
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 改變的條件 | 結論 |
| A | 升溫 | CO32-的水解平衡向右移動 |
| B | 加入AlCl3固體 | 產生大量氣體 |
| C | 加入100mLH2O | 溶液中c(H+)、c(OH-)均減小 |
| D | 加入少量CH3COONa固體 | 溶液中n(CO32-)增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com