
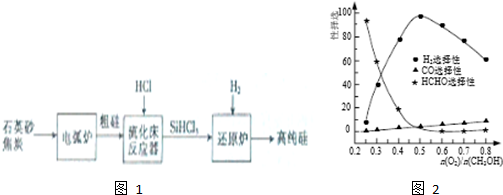
| 物質 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸點/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
分析 (1)根據氮化硅中各元素的原子最外層達到8電子穩定結構分析;
(2)氮氧化物與水反應生成硝酸,能形成酸雨,此外還形成光化學煙霧、臭氧層破壞;NO2在堿性條件下自身發生氧化還原反應生成硝酸鈉和亞硝酸鈉;
(3)①石英砂主要成分為二氧化硅,二氧化硅和碳在高溫的條件下反應生成碳化硅和一氧化碳;
②根據題中數據,采用精餾(或蒸餾)方法提純SiHCl3;
(4)根據1mol硅完全燃燒能放出910kJ的熱量書寫熱化學方程式,“硅能源”具有環保及儲存、運輸方便的特點;
(5)當n(O2)/n(CH3OH)=0.25時,CH3OH與O2發生的主要反應為甲醇的催化氧化生成甲醛;n(O2)/n(CH3OH)>0.5時,氧氣過量,與氫氣反應生成水;
解答 解:(1)氮化硅中各元素的原子最外層達到8電子穩定結構,Si原子最外層電子數為4,N原子最外層電子數為5,要形成8電子穩定結構,則應有二者個數比值為3:4,其化學式為Si3N4,
故答案為:Si3N4;
(2)氮氧化物與水反應生成硝酸,能形成酸雨,此外還形成光化學煙霧、臭氧層破壞;NO2在堿性條件下自身發生氧化還原反應生成硝酸鈉和亞硝酸鈉,反應的離子方程式為:2NO2+2OH-═NO3-+NO2-+H2O,
故答案為:酸雨、光化學煙霧、臭氧層破壞(任一點均可);2NO2+2OH-═NO3-+NO2-+H2O;
(3)①石英砂的主要成分是二氧化硅,在反應中生成碳化硅,反應為:SiO2+3C$\frac{\underline{\;高溫\;}}{\;}$SiC+2CO↑,
故答案為:SiO2+3C$\frac{\underline{\;高溫\;}}{\;}$SiC+2CO↑;
②利用沸點的不同提純SiHCl3屬于蒸餾,SiHCl3(沸點33.0℃)中含有少量SiCl4(沸點57.6℃)和SiH2Cl2(沸點8.2℃),SiH3Cl(沸點-30.4℃),由于沸點差別較大,可以通過精餾(或蒸餾)除去雜質,
故答案為:精餾(或蒸餾);
(4)1mol硅完全燃燒能放出910kJ的熱量,熱反應方程式為:Si(S)+O2(g)═SiO2(S)△H=-910KJ/mol,硅為固體,則“硅能源”具有產物不污染環境及儲存、運輸方便的特點,
故答案為:Si(S)+O2(g)═SiO2(S)△H=-910KJ/mol;產物不污染環境,儲存、運輸方便;
(5)根據圖象可知,當n(O2)/n(CH3OH)=0.25時,CH3OH與O2發生的主要反應為甲醇的催化氧化生成甲醛,反應的方程式為:2CH3OH+O2$→_{△}^{催化劑}$2HCHO+2H2O,n(O2)/n(CH3OH)>0.5時,氧氣過量,與氫氣反應生成水,H2選擇性下降,
故答案為:2CH3OH+O2$→_{△}^{催化劑}$2HCHO+2H2O;氧氣過量,與氫氣反應生成水;
點評 本題考查較綜合,側重考查了氮和硅及其化合物的有關知識,注意粗硅的提純反應原理,注意圖象正確分析,題目難度中等.


 小學奪冠AB卷系列答案
小學奪冠AB卷系列答案科目:高中化學 來源: 題型:多選題
| A. | 鈉和鉀的合金具有導電性,可用于中子反應堆熱交換劑 | |
| B. | 采用催化措施,將汽車尾氣中的CO和NO轉化為無害氣體 | |
| C. | 信息產業中的光纜的主要成分是單質硅 | |
| D. | 水玻璃易溶于水,可用于生產黏合劑和防火劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原電池放電過程中,負極質量一定減輕,正極質量一定增加 | |
| B. | 常溫下濃硫酸與鋁不反應,所以常溫下可用鋁制貯罐貯運濃硫酸 | |
| C. | 8NH3(g)+6NO2(g)=7N2(g)+12 H2O(g)△H<0該反應一定能自發進行 | |
| D. | 提取海帶中的碘元素時,為將I-完全氧化為I2,用HNO3作氧化劑比用H2O2效果好 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鋁、鐵及其化合物在工業生產中有著重要的應用.
鋁、鐵及其化合物在工業生產中有著重要的應用.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O2可用作供氧劑 | |
| B. | 硅膠多孔,吸水能力強,常用作袋裝食品的干燥劑 | |
| C. | SO2具有漂白性,常用藥食品的漂白 | |
| D. | K2FeO4可用于水的凈化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解質溶液中混入水,會影響電池反應 | |
| B. | 反應中,SOCl2既是溶劑,又是氧化劑 | |
| C. | 電池工作過程中,亞硫酰氯(SOCl2) 被還原為Li2SO3 | |
| D. | 電池工作過程中,金屬鋰提供的電子與正極區析出硫物質的量之比為4:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將pH=4 CH3COOH溶液加水稀釋10倍,溶液中各離子濃度均減小 | |
| B. | 用 CH3COOH溶液滴定等物質的量濃度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol/L的鹽酸溶液中加入等體積0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
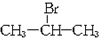 ;
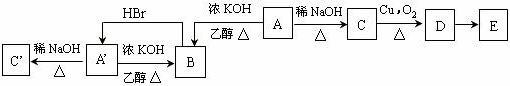
;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com