解答:
解:(1)圖象分析反應是放熱反應,反應的焓變=斷裂化學鍵吸收的能量-形成化學鍵放出的熱量=E
1-E
3,標注物質的聚集狀態和對應反應的焓變寫出熱化學方程式為:CO(g)+2H
2(g)?CH
3OH(g)△H=(E
1-E
3)或-(E
3-E
1)kJ?mol
-1 ,
故答案為:CO(g)+2H
2(g)?CH
3OH(g)△H=(E
1-E
3)或-(E
3-E
1)kJ?mol
-1 ;
(2)圖象分析可知是逆反應速率增大,反應是否達到平衡不知,所以增大逆反應速率的因素均符合,如加壓、等倍增加反應物和生成物、增加甲醇濃度、升高溫度、使用催化劑等,
故答案為:增加甲醇濃度;使用催化劑;
(3)判斷反應達到平衡狀態的依據正逆反應速率相等,平衡時各種物質的物質的量、濃度等不再發生變化;
A.無論反應是否達到平衡狀態,生成CH
3OH的速率與消耗CO的速率始終相等,所以不能作為判斷平衡狀態的依據,故A錯誤;
B.混合物的質量始終不變,容器的體積不變,所以混合氣體的密度始終不變,所以不能作為判斷平衡狀態的依據,故B錯誤;
C.反應前后,混合氣體的物質的量改變,氣體的質量不變,反應達到平衡狀態時,混合氣體的相對平均分子質量不變,所以能作為判斷平衡狀態的依據,故C正確;
D.反應達到平衡狀態時,CH
3OH、CO、H
2的濃度都不再發生變化,所以能作為判斷平衡狀態的依據,故D正確;
E.容器內CO、H
2、CH
3OH的濃度之比為1:2:1,和起始量,變化量有關,不能作為平衡的標志,故E錯誤;
故選CD;
(4)在一定溫度下,若將4a mol H
2和2a mol CO放入2L的密閉容器中,充分反應后測得CO的轉化率為50%,依據平衡三段式列式計算;
CO(g)+2H
2(g)?CH
3OH(g)
起始量(mol/L) a 2a 0
變化量(mol/L)50%×a a 0.5a
平衡量(mol/L)0.5a a 0.5a
則該反應的平衡常數K=
=
;
若此時再向該容器中投入a mol CO、2a mol H
2和a mol CH
3OH,濃度為c(CO)=
mol/L+0.5amol/L=amol/L,c(H
2)=
+amol/L=2a,c(CH
3OH)=
mol/L+0.5amol/L=amol/L,Q=
=
<K=
,判斷平衡移動的方向是反應正向進行;達到新平衡與原平衡相比,CO的物質的量濃度增大;
故答案為:
;正向移動;增大;
(4)燃料電池中,正極反應一定是氧氣得電子,該電池的電解質環境是熔融碳酸鹽,所以電極反應為:O
2+2CO
2+4e
-=2CO
32-,負極是燃料失電子生成二氧化碳,負極電極反應為:CH
4+4CO
32--8e
-=5CO
2+2H
2O;
故答案為:CO
2;CH
4+4CO
32--8e
-=5CO
2+2H
2O.

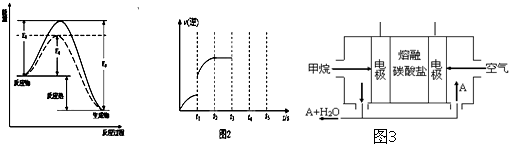


 (1)某可逆反應在不同條件下的反應歷程分別為A、B,如圖所示.
(1)某可逆反應在不同條件下的反應歷程分別為A、B,如圖所示. 據報道,一定條件下由二氧化碳和氫氣合成乙醇已成為現實.
據報道,一定條件下由二氧化碳和氫氣合成乙醇已成為現實.