
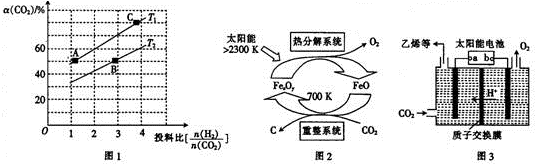
分析 (1)①依據熱化學方程式和蓋斯定律計算得到;
②當一個量在反應未平衡的時候一直在變化,而后來不變了,則可以作為平衡的標志,據此分析;
③T1溫度下,將6molCO2和12molH2充入2L的密閉容器中,由圖象可知,5min后反應達到平衡狀態時二氧化碳轉化率為60%,則生成CH3OCH30為6mol×60%×$\frac{1}{2}$=1.8mol,根據平均反應速率v(CH3OCH3)=$\frac{△c}{△t}$;根據平衡常數僅與溫度有關,溫度不變,平衡常數不變,在相同投料比時,T1溫度下二氧化碳轉化率大,所以T1溫度下較T2溫度下正向進行程度大.
(2)根據由CO2制取C的太陽能工藝圖示可知,CO2被FeO還原為C,則FeO將被氧化,根據重整系統發生的反應中$\frac{n(FeO)}{n(C{O}_{2})}$=4寫出化學方程式;
(3)電極a上通入CO2,生成C2H4,碳元素發生了還原反應,據此分析;根據化合價的變化結合溶液呈酸性來寫出電極方程式;
(4)反應NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常數K=$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}_{2}C{O}_{3})}{c(N{{H}_{4}}^{+})•c(HC{{O}_{3}}^{-})}$,而NH3•H2O的電離平衡常數表達式Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,H2C03的電離平衡常數K1=$\frac{c(HC{{O}_{3}}^{-})•c({H}^{+})}{c({H}_{2}C{O}_{3})}$,從而可得出平衡常數間的關系,據此分析.
解答 解:(1)①已知反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1 I
CH3OCH3(g)+H2O(g)?2CH3OH(g)△H2=+23.4kJ.mol-1 II
將I×2-II可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O (g)△H=(-53.7kJ.mol-1)×2-(+23.4kJ.mol-1)=-130.8 kJ.mol-1,故答案為:-130.8 kJ.mol-1;
②對于反應:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O (g)
a.由于是恒容的容器,容器體積V一直不變,而此反應全部是氣體參加和生成,故氣體的質量一直不變,則氣體的密度無論反應有沒有達到平衡都一直不變,故不能作為反應達平衡的標志,故a錯誤;
b.由于容器恒容,而此反應正反應方向是氣體的物質的量減小的反應,故反應在平衡之前,容器內的壓強在變小,故當壓強不變時,說明反應達平衡,故b正確;
c.此反應全部是氣體參加和生成,故氣體的質量一直不變,而正反應方向是氣體的物質的量減小的反應,故平衡之前,氣體平均相對分子質量在變大,故當不變時,能說明反應達平衡,故c正確;
d.反應前n(C02)=2mol,n(H2)=6mol,而根據物質的量的該變量等于計量數之比可知,△(C02):△(H2)=2:6,故無論反應是否達到平衡,n(C02):n(H2)恒等于2:6即1:3,故當比值不變時,不能說明反應達平衡,故d錯誤;
故選bc;
③T1溫度下,將6molCO2和12molH2充入2L的密閉容器中,由圖象可知,5min后反應達到平衡狀態時二氧化碳轉化率為60%,則生成CH3OCH30為6mol×60%×$\frac{1}{2}$=1.8mol,所以平均反應速率v(CH3OCH3)=$\frac{\frac{1.8mol}{2L}}{5min}$=0.18 mol/(L•min);
平衡常數僅與溫度有關,溫度不變,平衡常數不變,所以KA=KC,在相同投料比時,T1溫度下二氧化碳轉化率大,所以T1溫度下正向進行程度故T2溫度大,則KA=KC>KB,
故答案為:0.18 mol/(L•min);KA=KC>KB.
(2)由CO2制取C的太陽能工藝圖示可知,CO2被FeO還原為C,則FeO將被氧化,根據重整系統發生的反應中$\frac{n(FeO)}{n(C{O}_{2})}$=4,結合得失電子數守恒和質量守恒可知反應為:4FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe2O3,故答案為:4FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe2O3;
(3)電極a上通入CO2,生成C2H4,碳元素發生了還原反應,故電極a為陰極,則所連的是電源的負極;此電極上通入CO2,生成C2H4,碳元素的化合價由+4價變為-2價,結合溶液呈酸性可知極方程式為:2CO2+12e-+12H+=C2H4+4H2O,故答案為:負極;2CO2+12e-+12H+=C2H4+4H2O;
(4)反應NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常數K=$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}_{2}C{O}_{3})}{c(N{{H}_{4}}^{+})•c(HC{{O}_{3}}^{-})}$,而NH3•H2O的電離平衡常數表達式Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,H2C03的電離平衡常數K1=$\frac{c(HC{{O}_{3}}^{-})•c({H}^{+})}{c({H}_{2}C{O}_{3})}$,從而可得出平衡常數間的關系K=$\frac{Kw}{{K}_{b}•{K}_{1}}$=$\frac{1{0}^{-14}}{2×1{0}^{-5}×4×1{0}^{-7}}$=1.25×10-3,故答案為:1.25×10-3.
點評 本題考查了蓋斯定律的應用、反應達平衡的判斷以及平衡常數的有關計算等問題,綜合性較強,是高考的常見題型,難度較大.


 華東師大版一課一練系列答案
華東師大版一課一練系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1L0.1mol/L醋酸 | B. | 0.1L 0.1mol/L H2SO4溶液 | ||
| C. | 0.5L 0.1mol/L鹽酸 | D. | 2L 0.1mol/L H2SO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4HCO3溶液與過量KOH溶液反應的離子方程式:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| B. | 向Ba(OH)2溶液中滴入少量KHSO4溶液的離子方程式:SO42-+H++Ba2++OH-═BaSO4↓+H2O | |
| C. | 明礬水解的離子方程式:Al3++3H2O?Al(OH)3+3H+ | |
| D. | K37ClO3與濃鹽酸(HCl)在加熱時生成氯氣的化學方程式:K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 含4molHCl的濃鹽酸與足量MnO2充分反應,轉移2NA個電子 | |
| B. | 500℃、30MPa下,將0.2mol N2和0.6molH2置于密閉的容器中反應生成NH3(g),反應達到平衡時放出的熱量為7.72kJ,其熱化學方程式為:N2(g)+3H2(g)$?_{高溫高壓}^{催化劑}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 對于可逆反應N2(g)+3H2(g)$?_{高溫高壓}^{催化劑}$2NH3(g)△H<0,升高溫度,可使反應速率增大,反應逆向移動 | |
| D. | 元素原子的最外層電子數的多少與其非金屬性的強弱無必然聯系 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 中子數為18的氯原子可表示為18Cl | |
| B. | 鹽酸和食醋既是化合物又是酸 | |
| C. | 可以通過過濾的方法將淀粉膠體中混有的氯化鈉溶液除去 | |
| D. | 6.8g熔融KHSO4與3.9g熔融Na2O2中陰離子數目相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com