
【題目】銅、硼、硅、砷等元素的化合物是制造新型激光武器和新型太陽能電池的重要材料。回答下列問題:
(1)基態硅原子電子占據的最高能層符號是_____,其中能量最高的電子所占據能級的原子軌道有_____個伸展方向,原子軌道呈_____形。
(2)在硫酸銅溶液中通入過量的氨氣,小心蒸發,最終得到深藍色的[Cu(NH3)4]SO4晶體,晶體中含有的化學鍵除普通共價鍵外,還有____________。
(3)硒為第四周期元素,相鄰的元素有砷和溴,則三種元素的第一電離能從大到小的順序為________(用元素符號表示)。H2SeO3的酸性_______H2SeO4(填“強于”或“弱于”),原因是___________(從分子結構的角度回答)。
(4)氮化硼(BN)晶體有多種相結構。六方相氮化硼是通常存在的穩定相,與石墨相似,具有層狀結構,可作高溫潤滑劑。它的晶體結構如下左圖所示。六方相氮化硼______π鍵(填“含有”或“不含”),其質地軟的原因是_________。NaBH4是一種重要的儲氫載體,陰離子的的立體結構為_______。
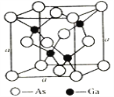
(5)砷化鎵是優良的第三代半導體材料。如上圖所示為GaAs的晶胞結構。
①與GaAs互為等電子體的一種原子晶體的化學式為________。
②已知晶胞的密度是ρ g·cm3,阿伏加德羅常數值為NA,棱長a=_____pm。
【答案】M 3 啞鈴 離子鍵、配位鍵 Br>As>Se 弱于 硒的含氧酸中非羥基氧原子數目越多,中心硒原子價態越高,導致Se—O—H中的O的電子更向Se偏移,越易電離出H+ 不含 層間作用力小,導致其質地軟 正四面體 SiC ![]()
【解析】
(1)基態硅原子電子占據的最高能層符號是M,其中能量最高的電子所占據能級的原子軌道p軌道,有3個伸展方向,原子軌道呈啞鈴形。(2)[Cu(NH3)4]SO4晶體中含有的化學鍵除普通共價鍵外,還有離子鍵、配位鍵。(3)砷的4p軌道電子處于半充滿狀態,穩定性強,第一電離能大于相鄰元素,則三種元素的第一電離能從大到小的順序為Br>As>Se;硒的含氧酸中非羥基氧原子數目越多,中心硒原子價態越高,導致Se—O—H中的O的電子更向Se偏移,越易電離出H+,所以H2SeO3的酸性弱于H2SeO4。(4)B位于第2周期ⅢA族,形成的六方相氮化硼,每一個B與3個N原子相連,每1個N原子與3個B原子相連,為平面三角形,向空間發展成層狀結構.六方相氮化硼,不含π鍵,只含σ鍵,層與層之間通過范德華力結合在一起;作用力小,導致其質地軟;BH4中B原子含有的價層電子對數是4,且不存在孤對電子,立體結構為正四面體。(5)①原子數和價電子數分別都相等的是等電子體,則與GaAs互為等電子體的一種原子晶體的化學式為SiC。②晶胞中含有的原子個數均是4個,已知晶胞的密度是ρ g·cm3,阿伏加德羅常數值為NA,則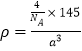 ,解得a=
,解得a=![]() =
=![]() pm。
pm。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】工業上,以鈦鐵礦為原料制備二氧化鈦的工藝流程如下圖所示。鈦鐵礦主要成分為鈦酸亞鐵( FeTiO3),其中一部分Fe2+在風化過程中會轉化為+3價。
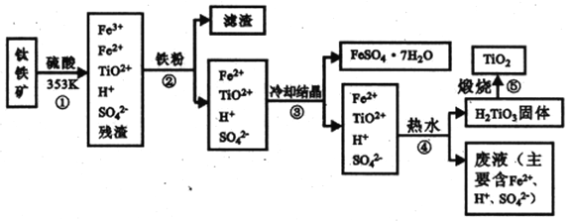
已知:TiO(OH)2(即H2TiO3)為兩性氫氧化物
(1)步驟②中,發生主要反應的離子方程式為__________。
(2)步驟③中,實現混合物的分離是利用物質的__________填字母序號)。
A.熔沸點差異 B.溶解性差異 C.氧化性、還原性差異
(3)步驟②、③、④中,均需用到的操作是__________(填操作名稱)。
(4)請結合化學用語,用化學平衡理論解釋步驟④中將TiO2+轉化為H2TiO3的原理:__________。
(5)上述工藝流程中可以循環利用的物質是__________
(6)研究發現,可以用石墨作陽極、鈦網作陰極、熔融CaF2-CaO作電解質,利用如圖所示裝置獲得金屬鈣,并以鈣為還原劑,還原二氧化鈦制備金屬鈦。
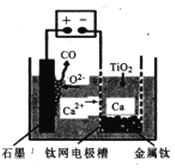
①寫出陽極所發生反應的電極反應式__________。
②在制備金屬Ti前后,CaO的質量將__________(填“增大”、“不變”或“減小”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2的含量是衡量大氣污染的一個重要指標,工業上常采用催化還原法或吸收法處理SO2。利用催化還原SO2不僅可消除SO2污染,而且可得到有經濟價值的單質S。
(1)在復合組分催化劑作用下,CH4可使SO2轉化為S,同時生成CO2和H2O。
己知CH4和S的燃燒熱(△H)分別為-890.3 kJ /mol和-297.2 kJ /mol,則CH4和SO2反應的熱化學方程式為 _________________________________________________。
(2)用H2還原SO2生成S的反應分兩步完成,如圖1所示,該過程中相關物質的物質的量濃度隨時間的變化關系如圖2所示:

①分析可知X為________(寫化學式), 0~t1時間段的溫度為_____, 0~t1時間段用SO2表示的化學反應速率為 ___________________________。
②總反應的化學方程式為__________________________________________________________。
(3)焦炭催化還原SO2生成S2,化學方程式為:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1 mol/LSO2與足量的焦炭反應,SO2的轉化率隨溫度的變化如圖3所示。
S2(g)+2CO2(g),恒容容器中,1 mol/LSO2與足量的焦炭反應,SO2的轉化率隨溫度的變化如圖3所示。
①該反應的△H _________________________ 0 (填“>”或“<”)
②計算700℃該反應的平衡常數為____________________ 。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含有C=C的有機物與O3作用形成不穩定的臭氧化物,臭氧化物在還原劑存在下,與水作用分解為羰基化合物,總反應為:![]()

![]() +
+![]() (R1、R2、R3、R4為H或烷基)。以下四種物質發生上述反應,所得產物為純凈物且含有醛基的是( )
(R1、R2、R3、R4為H或烷基)。以下四種物質發生上述反應,所得產物為純凈物且含有醛基的是( )
A. (CH3)2C=C(CH3)2 B. CH2=CHCH=CHCH=CH2 C.  D.
D. ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年度國家科學技術獎授予我國諾貝爾獎獲得者屠呦呦,表彰她在抗瘧疾青蒿素方面的研究。
(查閱資料)青蒿素熔點156~157℃,易溶于丙酮、氯仿和乙醚,在水幾乎不溶。
I.實驗室用乙醚提取青蒿素的工藝流程如下:

(1)在操作I前要對青蒿進行粉碎,其目的是________________
(2)操作II的名稱是_____________。
(3)操作III進行的是重結晶,其操作步驟為_____ 、_____、______、過濾、洗滌、干燥
II.已知青蒿素是一種烴的含氧衍生物為確定它的化學式,進行了如下實驗:

實驗步驟:①連接裝置,檢查裝置的氣密性。②稱量E、F中儀器及藥品的質量。③取14.10g青蒿素放入硬質試管C中,點燃C、D處酒精燈加熱,充分燃燒④實驗結束后冷卻至室溫,稱量反應后E、F中儀器及藥品的質量。
(4)裝置E、F應分別裝入的藥品為_______________、___________________。
(5)實驗測得:
裝置 | 實驗前 | 實驗后 |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
通過質譜法測得青蒿素的相對分子質量為282,結合上述數據,得出青蒿素的分子式為______。
(6)若使用上述方法會產生較大實驗誤差,你的改進方法是________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分:

根據要求回答下列問題:
(1)十種元素中化學性質最不活潑的元素是__________________(填元素符號,下同),形成化合物種類最多的元素是_____________________。
(2)A、C、D三種元素的最高價氧化物對應的水化物,其中堿性最強的是______________(填化學式,下同),E、H、G三種元素的最高價氧化物對應的水化物中酸性最強的是______________。
(3)I元素跟A元素形成化合物的電子式是______________。高溫灼燒該化合物時,火焰呈______________色。
(4)分別寫出B、G兩種單質和水反應的離子方程式_____________、________________。
(5)元素A和F能形成兩種化合物,寫出其中較穩定的化合物與CO2反應生成氧氣的化學方程式:__________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是金屬鎂和鹵素單質(X2)反應的能量變化示意圖。下列敘述中,正確的說法有幾項 ( )

①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2電解制Mg(s)和Cl2(g)是吸熱過程
③熱穩定性:MgI2>MgBr2>MgCl2>MgF2
④常溫下氧化性:F2<Cl2<Br2<I2
A. 1項 B. 2項
C. 3項 D. 4項
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列除去雜質(括號的物質為雜質)的方法中,錯誤的是
A. FeCl3溶液(FeCl2):通入適量Cl2
B. CO(CO2):通過NaOH溶液洗氣后干燥
C. MnO2(KCl):加水溶解后過濾、洗滌、烘干
D. CO2(HCl):通過飽和Na2CO3溶液洗氣后干燥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】捕碳技術是指從空氣中捕獲二氧化碳的各種科學技術的統稱。許多科學家認為從空氣中捕獲二氧化碳不僅在理論上可行,很快還會成為一個對付全球變暖的實用武器;目前NH3和(NH4)2CO3等物質已經被用作工業捕碳劑。
(1)下列物質中不可能作為CO2捕獲劑的是___________。
A.Na2CO3 B.HOCH2CH2NH2 C.CH3CH2OH D.NH4Cl
(2)工業上用NH3捕碳可合成CO (NH2)2:
已知:①標準狀況下,11.2L NH3與足量CO2完全反應生成NH2CO2 NH4 (s)時放出39.8kJ的熱量;②NH2CO2 NH4 (s)= CO(NH2)2(s)+ H2O(g) △H=+72.5 KJ·mol-1。
則2NH3(g)+CO2(g)=CO(NH2)2(s)+ H2O(g)的△H=_____________KJ·mol-1。
(3)用(NH4)2CO3捕碳的反應如下:
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2(NH4)2HCO3(aq)。為研究溫度對(NH4)2CO3捕獲CO2效率的影響,將一定量的(NH4)2CO3溶液置于密閉容器中,并充入一定量的CO2氣體,保持其它初始實驗條件不變,分別在不同溫度下,經過相同時間測得CO2氣體濃度,得到趨勢圖:
2(NH4)2HCO3(aq)。為研究溫度對(NH4)2CO3捕獲CO2效率的影響,將一定量的(NH4)2CO3溶液置于密閉容器中,并充入一定量的CO2氣體,保持其它初始實驗條件不變,分別在不同溫度下,經過相同時間測得CO2氣體濃度,得到趨勢圖:

①c點的逆反應速率和d點的正反應速率的大小關系為V逆c _____V正d (填“>”、“=”或“<”)
②b、c、d三點的平衡常數K b 、K c、 Kd 從大到小的順序為 _____________。(填“>”、“=”或“<”)
③在T2~T4溫度區間,容器內CO2氣體濃度呈現先減小后增大的變化趨勢,其原因是________。
(4)用堿性溶液也可捕碳:在常溫下,將0.04mol CO2通入200mL 0.2mol/L的Na2S溶液中,已知: H2CO3的電離平衡常數:K1=4.3×10—7、K2=5.6×10—11;H2S的電離平衡常數:K1=5.0×10—8、K2=1.1×10—12。回答下列問題
①發生反應的離子方程式為_____________________________
②充分反應后下列關系式中正確的是_____________________
A.(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
B.c(CO32-)+ c(HCO3-)+ c(H2CO3)>c(H2S)+c(HS-)+c(S2-)
C.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
③計算反應后的溶液中c(H2S).c(OH-)/c(HS-)的值為______________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com