
| A. | ①④ | B. | 僅②③ | C. | ②③④ | D. | 僅④ |
分析 根據化學平衡狀態的特征解答,當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,解題時要注意,選擇判斷的物理量,隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態.
解答 解:①混合氣體的密度不變,說明氣體的質量不變,反應達平衡狀態,故正確;
②兩邊氣體的計量數相等,所以混合氣體的壓強一直不變,故錯誤;
③混合氣體的總物質的量一直不變,故錯誤;
④B的物質的量濃度,說明正逆反應速率相等,反應達平衡狀態,故正確;
故選A.
點評 本題考查了化學平衡狀態的判斷,難度不大,注意當反應達到平衡狀態時,正逆反應速率相等,但不為0.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解NaCl飽和溶液,可制得金屬鈉 | |
| B. | 在海輪外殼上鑲入鋅塊,可減緩船體的腐蝕速率 | |
| C. | 尋找高效催化劑,利用太陽能分解水是制取氫氣的較理想方法 | |
| D. | MgO的熔點很高,可用于制作耐高溫材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 6種 | B. | 7種 | C. | 8種 | D. | 9種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S→SO2→SO3→H2SO4 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | N2→NO→NO2→HNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合氣體的顏色不再改變 | B. | 混合氣體的密度不再改變 | ||
| C. | 混合氣體的壓強不再改變 | D. | 混合氣體的平均分子質量不再改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 分別表示N2、H2、NH3和固體催化劑,則在固體催化劑表面合成氨的過程可用下圖4表示:
分別表示N2、H2、NH3和固體催化劑,則在固體催化劑表面合成氨的過程可用下圖4表示: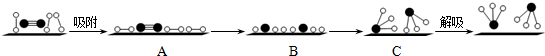
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲醇是一種可再生能源,具有廣泛的開發和應用前景.
甲醇是一種可再生能源,具有廣泛的開發和應用前景.| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com