
| A. | NaHCO3溶液呈堿性的原因是HCO3-的水解程度大于電離程度 | |
| B. | 加入CaCl2促進了HCO3-的水解 | |
| C. | 反應的離子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反應后的溶液中存在:c(Na+)+2c(Ca2+)═c(HCO3-)+2c(CO32-)+c(Cl-) |
分析 A.NaHCO3既能電離又能水解;
B.加入CaCl2消耗CO32-;
C.HCO3-與Ca2+生成CaCO3和氫離子,氫離子結合HCO3-生成H2CO3;
D.根據電荷守恒分析.
解答 解:A.NaHCO3既能電離又能水解,水解顯堿性,電離顯酸性,NaHCO3溶液呈堿性的原因是HCO3-的水解程度大于電離程度,故A正確;
B.溶液中存在HCO3-?CO32-+H+,加入CaCl2消耗CO32-,促進HCO3-的電離,故B錯誤;
C.HCO3-與Ca2+生成CaCO3和氫離子,氫離子結合HCO3-生成H2CO3,則反應的離子方程式,2HCO3-+Ca2+═CaCO3↓+H2CO3,故C正確;
D.溶液中存在電荷守恒,c(Na+)+c(H+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(OH-),溶液至pH=7,c(H+)=c(OH-),c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-),故D正確;
故選B.
點評 本題考查了電解質溶液中反應實質,沉淀溶解平衡的理解應用,電解質溶液中離子濃度大小、電荷守恒、物料守恒等知識,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| W | X | |
| Y | Z |
| A. | X、Y、Z三種元素的最簡單氫化物中最不穩定的是Y | |
| B. | W、Y、Z三種元素對應氧化物的水化物一定都是強酸 | |
| C. | W、X元素的最簡單氫化物都是非電解質 | |
| D. | Z元素的單質在化學反應中只能表現氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH可用于治療胃酸過多 | |
| B. | CaO可防止月餅等食品氧化變質 | |
| C. | 氫彈中用到的2H、3H互為同位素 | |
| D. | 向海水中加入凈水劑明礬可以使海水淡化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
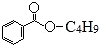 ,下列說法錯誤的是( )
,下列說法錯誤的是( )| A. | X難溶于水 | B. | X的分子式為C11H14O2 | ||
| C. | 組成為-C4H9的烴基有3種 | D. | X能發生加成反應、取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氨是重要的化工原料,用途廣泛.
氨是重要的化工原料,用途廣泛. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 32g氧氣與足量鋰完全反應得到的電子數為2NA | |
| B. | 在1L2mol•L-1MgCl2溶液中含有的Cl-數為2NA | |
| C. | 標準狀態下,2.24LCO2與2.24LH2O中所含原子數均為0.3NA | |
| D. | 標準狀況下,11.2L氯氣與足量NaOH溶液反應轉移的電子數為0.5NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com