
| A. | 3 mL | B. | 7.5 mL | C. | 15 mL | D. | 22.5 mL |
分析 n(AlCl3)=0.03 mol,n[Al(OH)3]=0.01 mol,由沉淀的物質的量小于氯化鋁的物質的量可推知此題可能有兩個答案:一是氫氧化鈉不足,二是氫氧化鈉過量,據此分析解答.
解答 解:n(AlCl3)=0.03 mol,n[Al(OH)3]=0.01 mol,由沉淀的物質的量小于氯化鋁的物質的量可推知此題可能有兩個答案:一是氫氧化鈉不足,二是氫氧化鈉過量;
由兩者反應的離子方程式知Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O知,
當堿的量不足時,只發生反應Al3++3OH-═Al(OH)3↓,根據氫氧化鋁和氫氧根離子之間的關系式得,則V(NaOH)=$\frac{\frac{0.78g}{78g/mol}×3}{4mol/L}$=7.5 mL;
當堿過量時,生成氫氧化鋁發生的反應為Al3++3OH-═Al(OH)3↓,根據氫氧化鋁和氫氧根離子之間的關系式得,則V(NaOH)=$\frac{\frac{0.78g}{78g/mol}×3}{4mol/L}$=7.5 mL;
根據鋁離子守恒得n(AlO2-)=0.03mol-0.01mol=0.02mol,發生的反應為Al3++4OH-═AlO2-+2H2O,根據方程式知,生成偏鋁酸根離子需要氫氧化鈉體積=$\frac{0.02mol×4}{4mol/L}$=20mL,
所以一共需要氫氧化鈉體積為:7.5mL+20mL=27.5mL,
故選B.
點評 本題考查了物質的量的有關計算,題目難度中等,明確氯化鋁和氫氧化鈉之間的反應是解本題關鍵,注意要分情況討論,很多同學往往漏掉氫氧化鈉溶液和氫氧化鋁的反應而導致錯誤,為易錯題.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在密閉容器中,加入1.5mol H2和0.5mol N 2充分反應后,可得到NH3分子數為NA | |
| B. | 常溫下,pH=2的醋酸溶液中所含H+的數目為0.01NA | |
| C. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的數目為0.1NA | |
| D. | 精煉銅時,陰極質量增加6.4g,則電路中轉移的電子數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應中轉移電子為0.04 mol | B. | Q中n(Cu2+):n(Fe2+)=1:2 | ||
| C. | 溶液Q比原溶液增重了 1.28 g | D. | 3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=0.1 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗序號 | 固體質量 | 加入某濃度鹽酸的體積/mL | 加入某濃度NaOH的體積/mL | 收集到氣體體積/mL |
| 1 | 0.9 | 20.0 | ─ | 1008 |
| 2 | 0.9 | 30.0 | ─ | 1008 |
| 3 | 0.9 | ─ | 20.0 | 672 |
| 4 | 0.9 | ─ | 30.0 | 672 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知ag乙烯氣體充分燃燒時生成1molCO2和液態水,放出bkJ的熱量,則表示乙烯燃燒熱的熱化學方程式為2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ•mol-1 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270kJ•mol-1,則1mol氫氣與1mol氟氣反應生成2mol液態氟化氫放出的熱量數值小于270kJ | |
| C. | 常溫常壓下,將0.5molN2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金剛石)+O2(g)═CO2(g)△H=-395.0kJ•mol-1 則C(s,金剛石)═C(s,石墨)△H=-1.5kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗序號 | 甲 | 乙 | 丙 |
| 合金質量(mg) | 255 | 385 | 459 |
| 標準狀況下氣體的體積(mL) | 280 | 336 | 336 |
| A. | 甲、乙組的實驗中,鹽酸均是過量的 | B. | 鹽酸的物質的量濃度為0.8mol L-1 | ||
| C. | 合金中鎂、鋁的物質的量之比為1:1 | D. | 丙組中鋁的物質的量為0.0045mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 氣體 | CO2 | HCl | HCl | SO2 |
| 液體 | H2O | NaOH | H2O | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
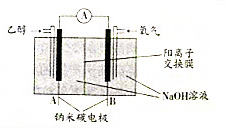
| A. | A極為電池負極,B極為電池正極 | |
| B. | B極的電極反應式為O2+2H2O+4e-═4OH- | |
| C. | 該乙醇燃料電池的總反應方程式為:C2H5OH+3O2═2CO2+3H2O | |
| D. | 當電池消耗4.6g乙醇時,經過陰離子交換膜的OH-為1.2mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com