
 某溶液可能含有如表離子
某溶液可能含有如表離子| 陽離子 | H+、K+、Al3+、NH4+、Mg2+ |
| 陰離子 | SO42-、OH- |
分析 根據圖象中沉淀先增加后部分溶解可知:溶液中一定含有:Mg2+和Al3+,所以一定不含OH-,加入8mol過氧化鈉會生成4mol氧氣,而圖象中生成了6mol氣體,說明生成的氣體除了過氧化鈉和溶液反應生成的氧氣之外,還一定有2mol其他氣體生成,而只能是氨氣,所以一定含有2mol銨根離子,所以根據電荷守恒可知一定含有SO42-,圖象中加入過氧化鈉的物質的量在0~amol之間時,沒有沉淀生成,所以溶液中含有H+,鉀離子不能確定是否存在,
(1)根據以上分析判斷;
(2)根據分析判斷溶液中的離子;當過氧化鈉物質的量為c時,沉淀減少2mol,發生的反應Al(OH)3+OH-═AlO2-+2H2O,據此計算氫氧化鈉的物質的量和過氧化鈉的物質的量,然后求出c;
(3)生成的沉淀有兩種,Mg(OH)2和Al(OH)3;
(4)圖象中加入過氧化鈉的物質的量在0~amol之間時,沒有沉淀生成,所以溶液中含有H+;
(5)鉀離子不能確定是否存在,可以用焰色反應檢驗.
解答 解:根據圖象中沉淀先增加后部分溶解可知:溶液中一定含有:Mg2+和Al3+,所以一定不含OH-,加入8mol過氧化鈉會生成4mol氧氣,而圖象中生成了6mol氣體,說明生成的氣體除了過氧化鈉和溶液反應生成的氧氣之外,還一定有2mol其他氣體生成,而只能是氨氣,所以一定含有2mol銨根離子,所以根據電荷守恒可知一定含有SO42-,圖象中加入過氧化鈉的物質的量在0~amol之間時,沒有沉淀生成,所以溶液中含有H+,鉀離子不能確定是否存在,
(1)根據以上分析可知,產生的氣體是NH3和O2;故答案為:O2;
(2)由分析可知溶液中存在的離子有:H+、Al3+、NH4+、Mg2+、SO42-;當過氧化鈉物質的量為c時,沉淀減少2mol,即Al(OH)3為2mol,發生的反應Al(OH)3+OH-═AlO2-+2H2O,則消耗的NaOH為2mol,所以過氧化鈉為1mol,則c=8+1=9;
故答案為:H+、Al3+、NH4+、Mg2+、SO42-;9;
(3)加Na2O2固體到bmol時所得的沉淀有兩種,Mg(OH)2和Al(OH)3;故答案為:Mg(OH)2和Al(OH)3;.
(4)圖象中加入過氧化鈉的物質的量在0~amol之間時,沒有沉淀生成,所以溶液中含有H+,發生的反應的離子方程式為:2Na2O2+4H+=4Na+2H2O+O2↑;
故答案為:2Na2O2+4H+=4Na+2H2O+O2↑;
(5)鉀離子不能確定是否存在,可以用焰色反應檢驗,具體操作是用鉑絲蘸蘸取少量溶液在無色火焰上灼燒,透過藍色鈷玻璃觀察火焰顏色,若呈紫色,則證明有K+,反之,則證明沒有K+,
故答案為:用鉑絲蘸蘸取少量溶液在無色火焰上灼燒,透過藍色鈷玻璃觀察火焰顏色,若呈紫色,則證明有K+,反之,則證明沒有K+.
點評 本題考查了常見的離子檢驗方法、離子方程式的書寫,題目難度中等,注意掌握常見的離子檢驗方法,能夠根據描述的反應現象判斷存在的離子,注意掌握氫氧化鋁的兩性及反應的方程式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
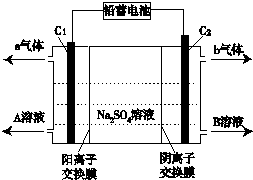
| A. | C1極電極與鉛蓄電池的Pb電極相接,C2極與鉛蓄電池的PbO2電極相接 | |
| B. | 當C1極產生標準狀況下11.2 L氣體時,鉛蓄電池的負極增重64g | |
| C. | A溶液為氫氧化鈉溶液,B溶液為硫酸 | |
| D. | 該電解反應的總方程式可以表示為:2Na2SO4+6H2O$\frac{\underline{\;電解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
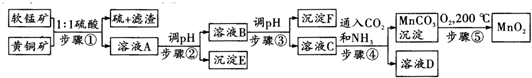
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 |
| 開始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 02是氧化劑,PtF6是還原劑 | |
| B. | 02 (PtF6)中氧元素的化合價為+1 | |
| C. | 02( PtF6)中不存在共價鍵 | |
| D. | 每生成1 mol O2 (PtF6)則轉移1 mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某H2S04溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×l0-8,由水電離出的c(H+)=1×10-11 mol•L-1 | |
| B. | 將0.02 mol.L-1 HCI溶液與0.02 mol•L-l Ba( OH)2溶液等體積混合后,溶液pH約為12 | |
| C. | 將一定體積稀鹽酸與稀氨水混合,當溶質為NH3•H20和NH4Cl時,溶液的pH≥7 | |
| D. | 向0.1 mol•L-1 Na2C03溶液中逐滴滴加0.1 mol•L-1稀鹽酸,溶液中c(HCO3-)先增大后減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
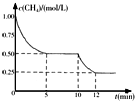 密閉容器中有反應CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,測得c(CH4)隨反應時間(t)變化如右圖所示.下列判斷正確的是( )
密閉容器中有反應CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,測得c(CH4)隨反應時間(t)變化如右圖所示.下列判斷正確的是( )| A. | 0~5 min內,v(H2)=0.1 mol/(L•min) | |
| B. | 10 min時改變的外界條件可能是升高溫度 | |
| C. | 恒溫下,縮小容器體積,平衡后c(H2)減小 | |
| D. | 12 min時反應達平衡的本質原因是氣體總質量不再變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | l mol H20最多可形成氫鍵數目為2NA | |
| B. | 標準狀況下,11.2 L甲醛所含的σ鍵數目為2NA | |
| C. | 常溫下,46 g N02所含分子數目為NA | |
| D. | pH=l的硫酸中所含S042-的數目為0.05NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳原子易失去最外層的電子形成離子 | |
| B. | 碳原子最外層電子易于其他原子的外層電子形成共同電子對 | |
| C. | 組成有機物的碳原子可以形成單鍵、雙鍵和三鍵等多種成鍵形式 | |
| D. | 組成有機物的氧原子、氮原子、鹵素原子分別形成2個、3個、1個共價鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com