
【題目】(1)科學家發現某藥物M能治療血管疾病,是因為它在人體內能釋放出一種“信使分子”D,已知M的相對分子質量為227,由C、H、O、N四種元素組成,C、H、N的質量分數依次為15.86%、2.20%和18.50%,則M的分子式是________________。D是雙原子分子,相對分子質量為30,則D的分子式為________________。
(2)油脂A經下列途徑可得到M:

圖中②的提示:R—OH+HO—NO2![]() R—O—NO2+H2O(R代表烴基),反應②的化學方程式為___________________________________。
R—O—NO2+H2O(R代表烴基),反應②的化學方程式為___________________________________。
(3)C是B和乙酸在一定條件下反應生成的化合物,相對分子質量為134,寫出C所有可能的結構簡式___________________________________。
(4)若將0.1 mol B與足量的金屬鈉反應,則需消耗________ g金屬鈉。
【答案】C3H5O9N3NO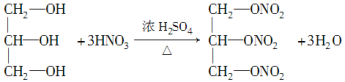
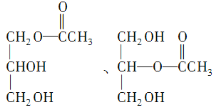 6.9
6.9
【解析】
試題本題考查有機物分子式的確定,油脂的水解,有機方程式的書寫,符合條件的有機物結構簡式的書寫,醇與Na反應的計算。
(1)1個M分子中N(C)=227![]() 15.86%
15.86%![]() 12=3,N(H)=227
12=3,N(H)=227![]() 2.20%
2.20%![]() 1=5,N(N)227
1=5,N(N)227![]() 18.50%
18.50%![]() 14=3,N(O)=(227—12
14=3,N(O)=(227—12![]() 3—1
3—1![]() 5—14
5—14![]() 3)
3)![]() 16=9,所以M的分子式為C3H5O9N3。“信使分子”的相對分子質量為30,為雙原子分子,D為NO。
16=9,所以M的分子式為C3H5O9N3。“信使分子”的相對分子質量為30,為雙原子分子,D為NO。
(2)油脂是高級脂肪酸甘油酯,經水解得到高級脂肪酸和甘油,則B為甘油,B的結構簡式為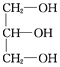 ,B屬于三元醇,反應②為甘油和HNO3按照給出的提示發生酯化反應生成M,反應的化學方程式為:
,B屬于三元醇,反應②為甘油和HNO3按照給出的提示發生酯化反應生成M,反應的化學方程式為: +3HO—NO2
+3HO—NO2![]()
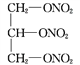 +3H2O。
+3H2O。
(3)B的相對分子質量為92,乙酸的相對分子質量為60,C的相對分子質量為134,C與B的相對分子質量相差134-92=42,則C是B與乙酸以物質的量之比1:1反應生成的酯,C可能的結構簡式為: 、
、 。
。
(4)因為B中含3個醇羥基,所以0.1 mol B要消耗0.3molNa,消耗Na的質量為0.3mol![]() 23g/mol=6.9g。
23g/mol=6.9g。


科目:高中化學 來源: 題型:
【題目】研究性學習小組用高錳酸鉀粉末與濃鹽酸制取氯氣,并驗證其性質。

(資料在線)高錳酸鉀粉末與濃鹽酸混合即產生氯氣。
請回答下列問題:
(1)該實驗中A部分的裝置應選用下圖中的______(填序號)

(2)實驗中A發生反應的離子方程式是_________。
(3)一段時間后D中的現象為_________。
(4)請你設計一個實驗,證明洗氣瓶C中的亞硫酸鈉已被氧化(簡述實驗步驟) _________。
(5)圖(1)整套實驗裝置存在的明顯缺陷是_________。
(6)圖(2)裝置a處通入氯氣,證明氯氣是否具有漂白性,該設計能否達到實驗目的? _________ (填“能”或“不能”)。若能請說明理由,若不能則提出改進的措施_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在化學反應X+2Y→R+2M 中,已知R和M的摩爾質量之比為22:9,當1.6克X與Y恰好完全反應后,生成4.4克R,則Y與M的質量依次為_____________,解答此題時使用到的化學定律是_____________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、F是家庭中常見的有機物,E是石油化工發展水平的標志,F是一種常見的高分子材料。根據下面轉化關系回答下列問題:

(1)操作⑥、操作⑦的名稱分別為________、________。
(2)下列物質中沸點最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中屬于取代反應的是________;原子利用率為100%的反應是________。(填序號)
(4)寫出結構簡式:A________、F________。
(5)寫出反應③的離子方程式:___________。
(6)作為家庭中常見的物質F,它給我們帶來了極大的方便,同時也造成了環境污染,這種污染稱為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近幾年我國大面積發生霧霾天氣,其主要原因是SO2、NOx等揮發性有機物等發生二次轉化,研究碳、氮、硫及其化合物的轉化對于環境的改善有重大意義。
(1)在一定條件下,CH4可與NOx反應除去NOx,已知有下列熱化學方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
則CH4(g)+2NO2(g) ![]() CO2(g)+2H2O(g)+N2 (g) △H=_____kJ·mol-1;該反應在_____(高溫,低溫,任何溫度)下可自發進行
CO2(g)+2H2O(g)+N2 (g) △H=_____kJ·mol-1;該反應在_____(高溫,低溫,任何溫度)下可自發進行
(2)SO2經過凈化后與空氣混合進行催化氧化可制取硫酸,其中SO2發生催化氧化的反應為: 2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0,在一定溫度下的定容容器中,能說明上述平衡達到平衡狀態的是:_______________。
2SO3(g) △H< 0,在一定溫度下的定容容器中,能說明上述平衡達到平衡狀態的是:_______________。
A. 混合氣體的密度不再發生變化 B.混合氣體的平均摩爾質量不再發生變化
C. v(SO2):v(O2):v(SO3)=2:1:2 D.混合氣體的總物質的量不再發生變化
(3)若在T1℃、0.1 MPa條件下,往一密閉容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],測得容器內總壓強與反應時間如下圖所示。

①圖中A點時,SO2的轉化率為________。
②在其他條件不變的情況下,測得T2℃時壓強的變化曲線如圖所示,則C點的正反應速率vc(正)與A點的逆反應速率vA(逆)的大小關系為vc(正)_____v A(逆) (填“>"、“<”或“ = ”)。
③圖中B點的平衡常數Kp=______。(Kp=壓強平衡常數,用平衡分壓代替平衡濃度計算,分壓=總壓物質的量分數)
(4)為了清除NO、NO2、N2O4對大氣的污染,常采用氫氧化鈉溶液進行吸收處理。現有由a mol NO、b molNO2、c molN2O4組成的混合氣體恰好被VL氫氧化鈉溶液吸收(無氣體剩余),則此氫氧化鈉溶液的物質的量濃度最小為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知充分燃燒a g乙炔氣體時生成1 mol二氧化碳氣體和液態水,并放出熱量b kJ,則乙炔燃燒的熱化學方程式正確的是
A. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1
B. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
C. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1
D. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、F是家庭中常見的有機物,E是石油化工發展水平的標志,F是一種常見的高分子材料。根據下面轉化關系回答下列問題:

(1)操作⑥、操作⑦的名稱分別為________、________。
(2)下列物質中沸點最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中屬于取代反應的是________;原子利用率為100%的反應是________。(填序號)
(4)寫出結構簡式:A________、F________。
(5)寫出反應③的離子方程式:___________。
(6)作為家庭中常見的物質F,它給我們帶來了極大的方便,同時也造成了環境污染,這種污染稱為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.常溫下,反應C(s)+CO2(g)=2CO(g)不能自發進行,則該反應的ΔH > 0
B.已知2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1,則CO的燃燒熱ΔH=-283 kJ
C.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,則稀H2SO4溶液和稀Ba(OH)2 溶液反應的反應熱ΔH ==2×(-57.3) kJ·mol-1
D.500℃、30MPa下,將0.5mol N2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,熱化學方程式為:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為![]() 的密閉容器內,物質
的密閉容器內,物質![]() 在
在![]() ℃時發生反應,其反應物和生成物的物質的量隨時間
℃時發生反應,其反應物和生成物的物質的量隨時間![]() 的變化關系如圖,下列敘述不正確的是( )
的變化關系如圖,下列敘述不正確的是( )
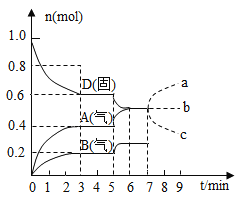
A. 若在第7分鐘時增加![]() 的物質的量,則表示
的物質的量,則表示![]() 的物質的量變化正確的是a曲線
的物質的量變化正確的是a曲線
B. 該反應的化學方程式為![]() ,該反應的平衡常數表達式為
,該反應的平衡常數表達式為![]()
C. 已知反應的![]() ,則第5分鐘時圖象呈現上述變化的原因可能是升高體系的溫度
,則第5分鐘時圖象呈現上述變化的原因可能是升高體系的溫度
D. 從反應開始到第一次達到平衡時,![]() 物質的平均反應速率為
物質的平均反應速率為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com