
【題目】馬日夫鹽[Mn(H2PO4)2·2H2O]主要用作磷化劑;以軟錳礦(主要成分為MnO2及少量的FeO、Al2O3和SiO2)為原料制備馬日夫鹽的主要工藝流程如圖:
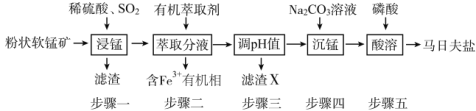
(1)按照無機物命名規律,馬日夫鹽[Mn(H2PO4)2·2H2O的化學名稱為___。
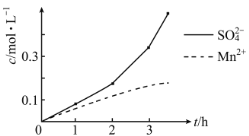
(2)步驟一中,MnO2被SO2和___還原。若SO2氣體中混有空氣,測得反應液中Mn2+、SO42-的濃度隨反應時間t變化如圖,科研人員認為Mn2+對O2與H2SO3反應起催化作用,其理由是__。
(3)濾渣X主要成分為___;步驟三調節pH時,最適宜加入的物質是__。
A.過量稀鹽酸 B.適量Na2CO3溶液
C.適量磷酸溶液 D.過量CaCO3
(4)在沉錳過程中,應將Na2CO3溶液逐量加入錳鹽溶液中,如果顛倒試劑混合順序會有Mn(OH)2生成,其原因是Na2CO3溶液具有較強__性;步驟五產生馬日夫鹽晶體的化學反應方程式為__。
(5)Fe3+的萃取率與溶液的pH和接觸時間之間的關系如圖,據此分析,萃取的最佳條件為____。
(6)馬日夫鹽作防銹磷化劑的原因是利用其較強的酸性以及在防銹處理過程中生成了具有保護作用的FeHPO4,馬日夫鹽顯酸性的主要原因是__(用相關化學用語回答)。
【答案】二水合磷酸二氫錳 FeO Mn2+增加到一定濃度后,硫酸根濃度迅速增大 氫氧化鋁 B 堿 MnCO3 + 2 H3PO4 + H2O = Mn(H2PO4)2·2H2O + CO2↑ pH =1.7下萃取60min H2PO4- ![]() H+ + HPO42-,磷酸二氫根電離大于水解,因此溶液顯酸性
H+ + HPO42-,磷酸二氫根電離大于水解,因此溶液顯酸性
【解析】
⑴按照無機物命名規律,馬日夫鹽Mn(H2PO4)2·2H2O的化學名稱為二水合磷酸二氫錳。
⑵步驟一中,軟錳礦中二氧化錳與氧化亞鐵、二氧化硫發生氧化還原反應,因此MnO2被SO2和FeO還原。若SO2氣體中混有空氣,測得反應液中Mn2+、SO42-的濃度隨反應時間t變化如圖,根據圖像分析得出在開始階段,錳離子和硫酸根相同,后來錳離子增加速率慢,硫酸根增加速度快,因此Mn2+對O2與H2SO3反應起催化作用。
⑶步驟一濾渣為濾渣SiO2,步驟二除掉鐵離子,步驟三種濾渣為氫氧化鋁;步驟三調節pH時,A選項,過量稀鹽酸,不能調節pH增大;B選項,適量Na2CO3溶液,消耗氫離子,pH增大;C選項,適量磷酸溶液,不能調節pH增大;D選項,過量CaCO3,消耗氫離子,pH增大,但會引入鈣離子雜質,因此B正確。
⑷在沉錳過程中,應將Na2CO3溶液逐量加入錳鹽溶液中,如果顛倒試劑混合順序會有Mn(OH)2生成,其原因是Na2CO3溶液水解,溶液具有較強堿性;步驟五產生馬日夫鹽晶體的化學反應方程式為MnCO3 + 2 H3PO4 + H2O = Mn(H2PO4)2·2H2O + CO2↑。
⑸Fe3+的萃取率與溶液的pH和接觸時間之間的關系如圖,根據圖像信息得出萃取的最佳條件為pH =1.7下萃取60min。
⑹馬日夫鹽作防銹磷化劑的原因是利用其較強的酸性以及在防銹處理過程中生成了具有保護作用的FeHPO4,馬日夫鹽顯酸性的主要原因是H2PO4- ![]() H+ + HPO42-,磷酸二氫根電離大于水解,因此溶液顯酸性。
H+ + HPO42-,磷酸二氫根電離大于水解,因此溶液顯酸性。
⑴按照無機物命名規律,馬日夫鹽Mn(H2PO4)2·2H2O的化學名稱為二水合磷酸二氫錳,故答案為:二水合磷酸二氫錳。
⑵步驟一中,軟錳礦中二氧化錳與氧化亞鐵、二氧化硫發生氧化還原反應,因此MnO2被SO2和FeO還原。若SO2氣體中混有空氣,測得反應液中Mn2+、SO42-的濃度隨反應時間t變化如圖,根據圖像分析得出在開始階段,錳離子和硫酸根相同,后來錳離子增加速率慢,硫酸根增加速度快,因此Mn2+對O2與H2SO3反應起催化作用,故答案為:FeO;Mn2+增加到一定濃度后,硫酸根濃度迅速增大。
⑶步驟一濾渣為濾渣SiO2,步驟二除掉鐵離子,步驟三種濾渣為氫氧化鋁;步驟三調節pH時,A選項,過量稀鹽酸,不能調節pH增大;B選項,適量Na2CO3溶液,消耗氫離子,pH增大;C選項,適量磷酸溶液,不能調節pH增大;D選項,過量CaCO3,消耗氫離子,pH增大,但會引入鈣離子雜質,故答案為:氫氧化鋁;B。
⑷在沉錳過程中,應將Na2CO3溶液逐量加入錳鹽溶液中,如果顛倒試劑混合順序會有Mn(OH)2生成,其原因是Na2CO3溶液水解,溶液具有較強堿性;步驟五產生馬日夫鹽晶體的化學反應方程式為MnCO3 + 2 H3PO4 + H2O = Mn(H2PO4)2·2H2O + CO2↑,故答案為:堿;MnCO3 + 2 H3PO4 + H2O = Mn(H2PO4)2·2H2O + CO2↑。
⑸Fe3+的萃取率與溶液的pH和接觸時間之間的關系如圖,根據圖像信息得出萃取的最佳條件為pH =1.7下萃取60min,故答案為:pH =1.7下萃取60min。
⑹馬日夫鹽作防銹磷化劑的原因是利用其較強的酸性以及在防銹處理過程中生成了具有保護作用的FeHPO4,馬日夫鹽顯酸性的主要原因是H2PO4- ![]() H+ + HPO42-,磷酸二氫根電離大于水解,因此溶液顯酸性,故答案為:H2PO4-
H+ + HPO42-,磷酸二氫根電離大于水解,因此溶液顯酸性,故答案為:H2PO4- ![]() H+ + HPO42-,磷酸二氫根電離大于水解,因此溶液顯酸性。
H+ + HPO42-,磷酸二氫根電離大于水解,因此溶液顯酸性。


 能力評價系列答案
能力評價系列答案 唐印文化課時測評系列答案
唐印文化課時測評系列答案 導學與測試系列答案
導學與測試系列答案科目:高中化學 來源: 題型:
【題目】將一定量的Cu和濃硫酸反應(裝置中的夾持、加熱儀器省略),反應后,圓底燒瓶內的混合液倒入水中,得到藍色溶液與少量黑色不溶物。
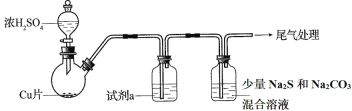
(1)反應后藍色溶液呈酸性的原因有①______________,②______________。
(2)為檢驗反應產生氣體的還原性,試劑 a 是______________。
(3)已知酸性:H2SO3>H2CO3>H2S。反應后測得 Na2S 和 Na2CO3 混合溶液中有新氣體生成。該氣體中 ______________ (填“含或不含”) H2S,理由是______________;
(4)少量黑色不溶物不可能是 CuO 的理由是______________。
查閱資料后發現該黑色固體可能是 CuS 或 Cu2S 中的一種或兩種,且 CuS 和 Cu2S 在空氣中煅燒易轉 化成 Cu2O 和 SO2。稱取 2.000g 黑色固體,灼燒、冷卻、……最后稱得固體 1.680g。
(5) 灼燒該固體除用到酒精燈、坩堝、坩堝鉗、三腳架等儀器,還需要______________。 確定黑色固體灼燒充分的依據是______________,黑色不溶物其成分化學式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是Zn和Cu組成的原電池示意圖,某小組做完該實驗后,在讀書卡片上記錄如下,卡片上描述合理的是( )
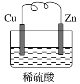
實驗記錄:
①導線中電流方向:Zn→Cu
②Cu極上有氣泡產生,發生還原反應
③鋅片變薄
實驗結論:
④Zn為正極,Cu為負極
⑤正極反應式:Cu-2e-=Cu2+,發生氧化反應
⑥H+向Cu極移動,SO42-向Zn極移動
A.②③⑥B.④⑤⑥
C.③④⑤D.①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻是一種銀白色金屬,化學性質穩定,在化合物中常見![]() 、
、![]() 和
和![]() 價等價態。工業上以鉻鐵礦
價等價態。工業上以鉻鐵礦![]() 主要成分為
主要成分為![]() ,含有
,含有![]() 、
、![]() 等雜質
等雜質![]() 為主要原料生產金屬鉻和重鉻酸鈉
為主要原料生產金屬鉻和重鉻酸鈉![]() 已知
已知 ![]() 是一種強氧化劑
是一種強氧化劑![]() ,其主要工藝流程如下:
,其主要工藝流程如下:
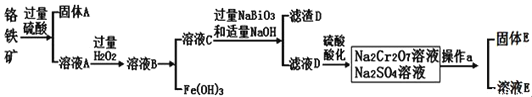
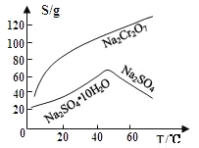
查閱資料得知:常溫下,![]() 不溶于水,有強氧化性,在堿性條件下,能將
不溶于水,有強氧化性,在堿性條件下,能將![]() 轉化為
轉化為![]()
回答下列問題:
![]() 工業上常采用熱還原法制備金屬鉻,寫出以
工業上常采用熱還原法制備金屬鉻,寫出以![]() 為原料,利用鋁熱反應制取金屬鉻的化學方程式_______________。
為原料,利用鋁熱反應制取金屬鉻的化學方程式_______________。
![]() 酸化濾液D時,不選用鹽酸的原因是_____________。
酸化濾液D時,不選用鹽酸的原因是_____________。
![]() 固體E的主要成分是
固體E的主要成分是![]() ,根據如圖分析操作a為________________、____________、洗滌、干燥。
,根據如圖分析操作a為________________、____________、洗滌、干燥。
![]() 已知含
已知含![]() 價鉻的污水會污染環境,電鍍廠產生的鍍銅廢水中往往含有一定量的
價鉻的污水會污染環境,電鍍廠產生的鍍銅廢水中往往含有一定量的![]() 。
。
![]()
![]() 的化學性質與
的化學性質與 ![]() 相似。在上述生產過程中加入NaOH溶液時要控制溶液的pH不能過高,是因為________
相似。在上述生產過程中加入NaOH溶液時要控制溶液的pH不能過高,是因為________![]() 用離子方程式表示
用離子方程式表示![]() ;
;
![]() 下列溶液中可以代替上述流程中
下列溶液中可以代替上述流程中![]() 溶液最佳的是___________
溶液最佳的是___________![]() 填選項序號
填選項序號![]() ;
;
A ![]() 溶液
溶液 ![]() 濃
濃![]()
![]() 酸性
酸性![]() 溶液
溶液 ![]() 溶液
溶液
![]() 上述流程中,每消耗
上述流程中,每消耗![]() 轉移
轉移![]() ,則加入
,則加入![]() 溶液時發生反應的離子方程式為_____________。
溶液時發生反應的離子方程式為_____________。
![]() 某廠廢水中含
某廠廢水中含![]() 的
的![]() ,某研究性學習小組為了變廢為寶,將廢水處理得到磁性材料
,某研究性學習小組為了變廢為寶,將廢水處理得到磁性材料 ![]() 的化合價為
的化合價為![]() ,Fe的化合價依次為
,Fe的化合價依次為![]() 、
、![]() 。欲使1L該廢水中的
。欲使1L該廢水中的 ![]() 完全轉化為
完全轉化為![]() 。理論上需要加入________
。理論上需要加入________![]() 。
。
![]() 已知
已知![]() 摩爾質量為
摩爾質量為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為2 L的密閉容器中發生反應xA(g)+yB(g)![]() zC(g)。圖甲表示200 ℃時容器中A、B、C物質的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分數隨起始n(A)∶n(B)的變化關系。則下列結論正確的是( )
zC(g)。圖甲表示200 ℃時容器中A、B、C物質的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分數隨起始n(A)∶n(B)的變化關系。則下列結論正確的是( )
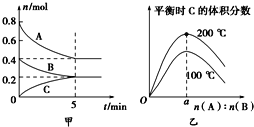
A. 200℃時,反應從開始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃時,該反應的平衡常數為25
C. 當外界條件由200℃降溫到100℃,原平衡一定被破壞,且正逆反應速率均增大
D. 由圖乙可知,反應xA(g)+yB(g)![]() zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為達到下列實驗目的,對應的實驗方法以及相關解釋均正確的是( )
選項 | 實驗目的 | 實驗方法 | 相關解釋 |
A | 測量氯水的pH |
| pH試紙遇酸變紅 |
B | 探究正戊烷(C5H12) 催化裂解 |
| C5H12裂解為分子較小的烷烴和烯烴 |
C | 實驗溫度對平衡移動的影響 |
| 2NO2(g) |
D | 用AlCl3溶液制備AlCl3晶體 |
| AlCl3沸點高于溶劑水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的鹽酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物質的量分數與加入鹽酸的體積的關系如圖所示。
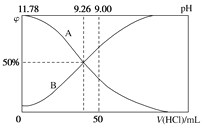
根據圖象回答下列問題。
(1)表示NH3·H2O濃度變化的曲線是_____(填“A”或“B”)。
(2)NH3·H2O的電離常數為_____。
(3)當加入鹽酸體積為50 mL時,溶液中c(NH4+)-c(NH3·H2O)=___ mol·L-1(用數字表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中山大學中山醫學院顏光美教授課題組發現一種叫![]() 的天然病毒(屬于蛋白質),其能殺死癌細胞而不傷害正常細胞,該病毒含有C、H、O、N、S等元素,其直徑大約為
的天然病毒(屬于蛋白質),其能殺死癌細胞而不傷害正常細胞,該病毒含有C、H、O、N、S等元素,其直徑大約為![]() 。下列說法不正確的是( )。
。下列說法不正確的是( )。
A.![]() 病毒中的C、H、O、N、S原子最有可能以共價鍵結合
病毒中的C、H、O、N、S原子最有可能以共價鍵結合
B.![]() 病毒不屬于高分子化合物
病毒不屬于高分子化合物
C.![]() 病毒溶于水形成的液體具有丁達爾效應
病毒溶于水形成的液體具有丁達爾效應
D.![]() 病毒在生物體內的水解產物可能是氨基酸
病毒在生物體內的水解產物可能是氨基酸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com