
| H2CO3 | Ka1=4.3×10-7 | HClO | Ka=2.95×10-8 |
| Ka2=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液體積/mL | 100 | 100 | 100 | 100 |
| 加入粉末質量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末質量/g | 0 | 0.64 | 3.2 | 6.4 |
分析 (1)向FeBr2溶液中滴加少量氯水,氯氣會將亞鐵離子和溴離子氧化;鐵離子的檢驗用硫氰化鉀溶液;
(2)根據電解池中陰離子的放電順序結合電極反應式來書寫;
(3)①弱酸的酸性越弱,其酸根越易結合氫離子;
②析出沉淀時,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{-})}}$,c(Ag+)越小,則越先生成沉淀;
(4)2mol•L-1的FeCl3溶液中,加入鐵、銅組成的均勻粉末狀混合物,先是金屬鐵和氯化鐵之間的反應,金屬鐵消耗完畢后,是金屬銅和氯化鐵之間的反應,根據提供數據結合金屬的反應先后順序來回答判斷.
解答 解:(1)向FeBr2溶液中滴加少量氯水,氯氣會將亞鐵離子和溴離子氧化,產物分別是鐵離子和溴單質,鐵離子在溶液中呈現淺黃色,所以使溶液變黃的微粒鐵離子的是鐵離子,檢驗鐵離子可以用硫氰化鉀溶液,溶液會變紅色,故答案為:Fe3+;取適量反應后的溶液滴加KSCN溶液變紅;
(2)電解池中陰離子的放電順序:碘離子>溴離子>氯離子,陽極首先發生反應的是碘離子,反應的電極反應式是:2I--2e-=I2;故答案為:2I--2e-=I2;
(3)①弱酸的酸性越弱,其酸根越易結合氫離子,根據表中數據,平衡常數越小,對應弱酸的酸性越弱,越易結合氫離子,所以等物質的量濃度的Na2CO3、CH3COONa、NaClO組成的混合溶液中逐滴加入稀硫酸,首先發生反應的離子方程式是CO32-+H+=HCO3-,故答案為:CO32-+H+=HCO3-;
②析出沉淀時,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$=1.56×10-8,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$=3×10-5,氯離子和鉻酸根離子的濃度是相等的,c(Ag+)越小,則越先生成沉淀,所以種陰離子產生沉淀的先后順序為Cl->CrO42-,故答案為:AgCl;
(4)①根據后三組數據可以看出,多加入金屬的質量和多剩余金屬的質量之比是一定值,所以最后應該是金屬鐵完全消耗,金屬銅剩余,鐵離子完全反應的情況,所以粉末中鐵、銅的物質的量相等,物質的量之比為1:1,故答案為:1:1;
②加入金屬鐵和金屬銅,沒有金屬剩余,金屬鐵和氯化鐵反應一定會產生亞鐵離子,銅和鐵離子之間反應一定會生成銅離子和亞鐵離子,根據第二組數據,加入金屬混合物6.6g,剩余金屬是0.64g,所以加入3g金屬時,鐵離子還會剩余,故Ⅰ反應后的溶液中存在的金屬陽離子有:Fe3+、Fe2+、Cu2+.
故答案為:Fe3+、Fe2+、Cu2+.
點評 本題綜合考查學生混合物組成的計算、電解池的工作原理、沉淀溶解平衡的計算等知識,屬于綜合知識的考查,難度不大.


 互動英語系列答案
互動英語系列答案科目:高中化學 來源: 題型:解答題
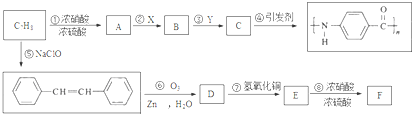
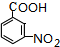 .A~E中互為同分異構體的還有
.A~E中互為同分異構體的還有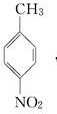 和
和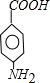 .(填結構簡式)
.(填結構簡式)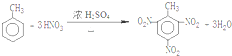 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
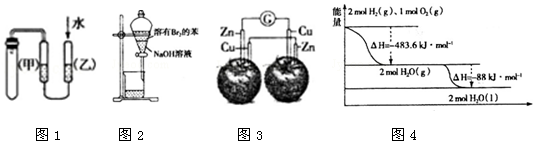
| A. | 圖1的目的是檢驗裝置的氣密性 | |
| B. | 圖2中分液漏斗振蕩靜置后,上層液體顏色變淺 | |
| C. | 圖3中電流計的指針不發生偏轉 | |
| D. | 圖4液態水分解的熱化學方程式為:2H2O(1)═2H2(g)+O2(g)△H=+571.6KJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
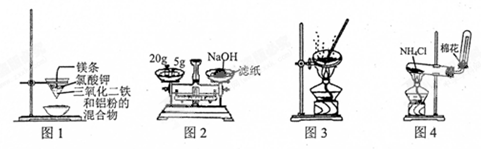
| A. | 用圖1裝置制取金屬鐵 | |
| B. | 用圖2裝置稱量NaOH固體 | |
| C. | 用圖3裝置蒸干CuCl2飽和溶液制備CuCl2晶體 | |
| D. | 用圖4裝置制取氨氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2個 | B. | 3個 | C. | 4個 | D. | 5個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應的速率主要①決定 | B. | HClI是該反應的催化劑 | ||
| C. | v(H2)=v(HCl)=v(I2) | D. | a值越小,該反應速率越快 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  | B. | 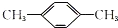 | C. | 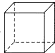 (立方烷) (立方烷) | D. | 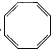 (環辛四烯) (環辛四烯) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①⑤ | B. | ⑤ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com