

| A. | 圖②中Cr2O72-離子向惰性電極移動,與該極附近的OH-結合轉化成Cr(OH)3除去 | |
| B. | 圖②的電解池中,有0.084 g陽極材料參與反應,陰極會有33.6 mL的氣體產生 | |
| C. | 圖①中發生的還原反應是:Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 若圖①中3.6 g鎂溶解產生的電量用以圖②廢水處理,理論可產生10.7 g氫氧化鐵沉淀 |
分析 A.圖②中惰性電極為陰極;
B.圖②陽極反應式是Fe-2e-═Fe2+,陰極反應式是2H++2e-=H2↑;
C.該原電池中,鎂作負極,負極上鎂失電子發生氧化反應,負極反應為Mg-2e-=Mg2+,電池反應式為Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正極上次氯酸根離子得電子發生還原反應;
D.由電子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,以此計算.
解答 解:A.圖②中惰性電極為陰極,Fe電極為陽極,則Cr2O2-7離子向金屬鐵電極移動,與亞鐵離子發生氧化還原反應生成的金屬陽離子與惰性電極附近的OH-結合轉化成Cr(OH)3除去,故A錯誤;
B.圖②圖乙的電解池中,陽極反應式是Fe-2e-═Fe2+,陰極反應式是2H++2e-=H2↑,則n(Fe)=$\frac{0.084g}{56g/mol}$=0.0015mol,陰極氣體在標況下的體積為0.0015mol×22.4L/mol=0.0336L=33.6mL,未指明標況,故B錯誤;
C.該原電池中,鎂作負極,負極上鎂失電子發生氧化反應,負極反應為Mg-2e-=Mg2+,電池反應式為Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正極上次氯酸根離子得電子發生還原反應,則總反應減去負極反應可得正極還原反應為Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,故C正確;
D.由電子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,則n(Mg)=$\frac{3.6g}{24g/mol}$=0.15mol,理論可產生氫氧化鐵沉淀的質量為0.15mol×107g/mol=16.05g,故D錯誤;
故選C.
點評 本題綜合考查電解原理,涉及電解、氧化還原反應、電子守恒的計算等問題,為高頻考點,要求具有較好的分析和解決問題的能力,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:HBr<HCl<HF | B. | 原子半徑:I<Br<Cl | ||
| C. | 酸性:HClO4<HBrO4<HIO4 | D. | 非金屬性:F<Cl<Br |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體區別與其他分散系的本質特征是分散質的粒子直徑在1-100nm之間 | |
| B. | 用平行光照射CuSO4溶液和氫氧化鐵膠體,不可以加以區分 | |
| C. | 膠體是純凈物 | |
| D. | 樹林中的晨曦,該現象與丁達爾效應無關 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{vn}{22.4}$ | B. | $\frac{22.4n}{v}$ | C. | $\frac{vn}{5.6}$ | D. | $\frac{22.4n}{3v}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 250C101KPa條件下,1摩爾任何氣體的體積都是22.4升 | |
| B. | 標準狀況下,體積是22.4升的物質,其物質的量一定是1摩爾 | |
| C. | 同溫同壓下兩種氣體,只要分子數相同,所占體積相同,質量也相同 | |
| D. | 同質量的O2和O3所含的氧原子數相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol N2所含有的原子數為NA | |
| B. | 標準狀況下,22.4 L水中含有的水分子數為NA | |
| C. | 標準狀況下,22.4 LHF所含的分子數為NA | |
| D. | 24 g O2分子和24 g O3分子所含的分子數不相等,氧原子數目相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
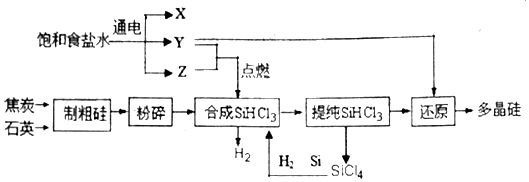
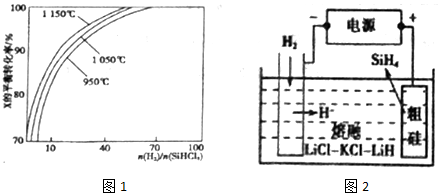
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 酸 | H2C2O4 | HF | H2CO3 | H3BO3 |
| 電離平衡常數Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com