
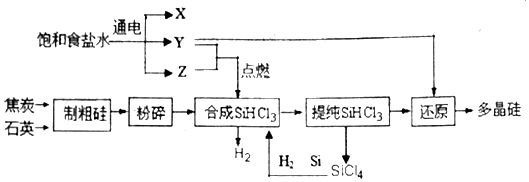
分析 (1)用惰性電極電解飽和食鹽水生成氫氧化鈉、氫氣和氯氣,又Y與Z點燃反應,則X為氫氧化鈉,Z為氯氣,據此書寫;
(2)根據沸點不同分離的方法為蒸餾;
(3)①根據圖象可知:橫坐標表示氫氣的量增多;
②溫度越高,SiHCl3的轉化率高,即反應進行的程度大;
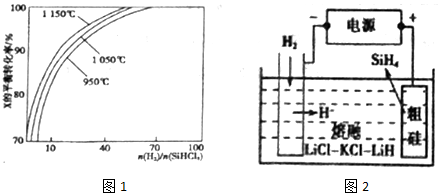
(4)電解池中的陽極上發生失電子的氧化反應,單質硅失電子后和H-結合生成SiH4;
解答 解:(1)用惰性電極電解飽和食鹽水生成氫氧化鈉、氫氣和氯氣,又Y與Z點燃反應,則X為氫氧化鈉,所以常溫下X與Z反應的化學方程式Cl2+2NaOH=NaCl+NaClO+H2O,故答案為:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)因為兩物質的沸點分別為57.6℃和31.8℃,所以提純SiHCl3的方法是蒸餾,故答案為:蒸餾;
(3)①兩種反應物,增加其中一種,另一種物質的轉化率增大,自身的轉化率反而減小,橫坐標表示氫氣的量增多,所以縱坐標表示的轉化率提高應為SiHCl3,故答案為:SiHCl3;
②當$\frac{n(H{\;}_{2})}{n(SiHCl{\;}_{3})}$一定時,溫度越高,SiHCl3的轉化率高,即反應進行的程度大,所以高溫時的化學平衡常數大,則該反應的平衡常數隨溫度升高而增大,即K(1150℃)>K(950℃);
故答案為:>;
(4)從圖示知,H-移向陽極生成SiH4,電極反應式為Si+4H--4e-=SiH4↑,故答案為:Si+4H--4e-=SiH4↑.
點評 本題考查硅及其化合物的性質,讀懂圖象、理順平衡常數與轉化率間的關系、注意電化學電極反應式的書寫是解題的關鍵,題目難度中等.


 學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案
學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案 芒果教輔暑假天地重慶出版社系列答案
芒果教輔暑假天地重慶出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1mol | B. | 15mol | C. | 22mol | D. | 5mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 圖②中Cr2O72-離子向惰性電極移動,與該極附近的OH-結合轉化成Cr(OH)3除去 | |
| B. | 圖②的電解池中,有0.084 g陽極材料參與反應,陰極會有33.6 mL的氣體產生 | |
| C. | 圖①中發生的還原反應是:Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 若圖①中3.6 g鎂溶解產生的電量用以圖②廢水處理,理論可產生10.7 g氫氧化鐵沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用10ml量筒量取7.13ml稀鹽酸 | |
| B. | 用托盤天平稱量25.20g NaCl | |
| C. | 用廣泛pH試紙測得某溶液的pH為2.3 | |
| D. | 中和滴定時用去某濃度的堿溶液21.70mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將等體積、等物質的量濃度的CH3COONH4與CH3COONa溶液混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) | |
| B. | 0.1mol•L-1pH為4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| C. | 物質的量濃度相等的①NH4Cl ②(NH4)2SO4 ③NH4Al(SO4)2三種溶液中,c(NH4+)由大到小的順序為:③>②>① | |
| D. | 向0.10mol•L-1 Na2CO3溶液中通入少量CO2的溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溫度相同、體積相同的O2和N2 | B. | 質量相等、密度不等的N2和C2H4 | ||
| C. | 壓強相等、溫度相等的CO和C2H4 | D. | 壓強相同、體積相同的N2和O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同溫同壓下兩種氣體的體積之比等于摩爾質量之比 | |
| B. | 同溫同壓下兩種氣體的物質的量之比等于密度之比 | |
| C. | 同溫同壓下兩種質量相同的氣體其體積比之比等于摩爾質量之比 | |
| D. | 同溫同體積下兩種氣體的物質的量之比等于壓強之比 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 丙烯分子中3個碳原子都是sp3雜化 | |
| B. | 每個丙烯分子有7個σ鍵,1個π鍵 | |
| C. | 丙烯分子是存在非極性鍵和極性鍵的極性分子 | |
| D. | 丙烯分子為手性分子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com