

分析 右室中混合氣體總物質的量不變,平衡時左室與右室壓強相等,溫度、壓強相同條件下,體積之比等于氣體物質的量之比,降低溫度由平衡(I)向平衡(II)移動,左室中體積減小,則左室中混合氣體總物質的量減小,說明左室中降低溫度平衡向右移動;
利用體積之比等于物質的量的之比,則平衡I左室中氣體總物質的量為2mol×$\frac{2.8}{2.2}$=$\frac{28}{11}$mol,則:
X(g)+2Y(g)?2Z(g)物質的量減少△n=1
起始量(mol):1 2 0
變化量(mol):$\frac{5}{11}$ $\frac{10}{11}$ $\frac{10}{11}$ 3-$\frac{28}{11}$=$\frac{5}{11}$
平衡量(mol):):$\frac{6}{11}$ $\frac{12}{11}$ $\frac{10}{11}$
再根據平衡常數K=$\frac{{c}^{2}(Z)}{c(X)×{c}^{2}(Y)}$計算.
解答 解:右室中混合氣體總物質的量不變,平衡時左室與右室壓強相等,溫度、壓強相同條件下,體積之比等于氣體物質的量之比,降低溫度由平衡(I)向平衡(II)移動,左室中體積減小,則左室中混合氣體總物質的量減小,說明左室中降低溫度平衡向右移動,則正反應為放熱反應,
利用體積之比等于物質的量的之比,則平衡I左室中氣體總物質的量為2mol×$\frac{2.8}{2.2}$=$\frac{28}{11}$mol,則:
X(g)+2Y(g)?2Z(g)物質的量減少△n=1
起始量(mol):1 2 0
變化量(mol):$\frac{5}{11}$ $\frac{10}{11}$ $\frac{10}{11}$ 3-$\frac{28}{11}$=$\frac{5}{11}$
平衡量(mol):):$\frac{6}{11}$ $\frac{12}{11}$ $\frac{10}{11}$
達到平衡(Ⅰ)時X的轉化率為$\frac{\frac{5}{11}mol}{1mol}$×100%=45.45%;
平衡常數K=$\frac{{c}^{2}(Z)}{c(X)×{c}^{2}(Y)}$=$\frac{(\frac{5}{11})^{2}}{\frac{3}{11}×(\frac{6}{11})^{2}}$mol/L=2.55mol/L,
故答案為:放熱;45.45%;2.55mol/L.
點評 本題考查化學平衡計算,難度中等,注意右室中反應體系的物質的量不變、且左室與右室壓強相等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 由H2(g)、I2(g)、HI(g)組成的平衡體系加壓后顏色變深 | |
| B. | 紅棕色的NO2,加壓后顏色先變深后變淺 | |
| C. | 實驗室用排飽和食鹽水法收集氯氣 | |
| D. | 工業上利用O2與SO2反應制取SO3時通入過量O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol Fe與足量的鹽酸反應 | B. | 0.4mol Cu投入到足量的稀硫酸中 | ||
| C. | 0.1mol Al與足量的NaOH溶液反應 | D. | 0.1mol Fe與足量的水反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
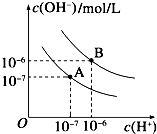 已知水在25℃和95℃時的電離平衡曲線如下圖所示:
已知水在25℃和95℃時的電離平衡曲線如下圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在80℃時,將0.4mol的四氧化二氮氣體充入2L已抽空的固定容積的密閉容器中,隔一段時間對該容器內的物質進行分析,得到如下數據:
在80℃時,將0.4mol的四氧化二氮氣體充入2L已抽空的固定容積的密閉容器中,隔一段時間對該容器內的物質進行分析,得到如下數據:時間(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某研究小組為了探究“鐵與水蒸氣”能否發生反應及反應的產物,進行了下列實驗:用如圖所示實驗裝置,在硬質玻璃管B中放入鐵粉和石棉絨的混合物,再結合一些步驟,就可以完成髙溫下“Fe與水蒸氣的反應實驗”(己知石棉絨是耐高溫材料,不與水和鐵反應).
某研究小組為了探究“鐵與水蒸氣”能否發生反應及反應的產物,進行了下列實驗:用如圖所示實驗裝置,在硬質玻璃管B中放入鐵粉和石棉絨的混合物,再結合一些步驟,就可以完成髙溫下“Fe與水蒸氣的反應實驗”(己知石棉絨是耐高溫材料,不與水和鐵反應).| 實驗步驟 | 預期實驗現象與結論 |
| 取反應后干燥的固體于試管中,加入足量的1mol•L-1硫酸溶解 | |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 只有在t1℃時,NaCl和MgSO4的溶解度才相等 | |
| B. | t1℃~t2℃,MgSO4的溶解度隨溫度升高而減小 | |
| C. | 在t2℃時,MgSO4飽和溶液的溶質質量分數最大 | |
| D. | 把MgSO4飽和溶液的溫度從t3℃降至t2℃時,有晶體析出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (1)(2) | B. | (2)(4) | C. | (2)(5) | D. | (3)(6) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com