
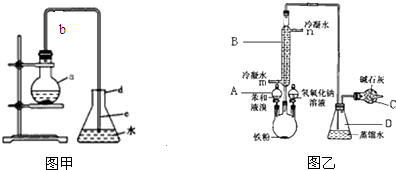
分析 (1)根據苯和液溴在鐵作催化劑的條件下生成溴苯和HBr;
(2)苯與液溴發生取代反應,生成溴苯和HBr,由于反應放熱,溴、苯沸點低,易揮發,所以從導管導出的氣體中可能含有一定的溴和苯;
(3)根據滴加AgNO3溶液能與溴離子反應生成淺黃色的溴化銀沉淀,說明溴單質和苯的反應是發生了取代反應,苯是無色、密度大于水的液體;
(4)根據冷凝效果判斷水的流動方向,反應尾氣中有揮發的溴和生成的溴化氫,能污染空氣,所以要吸收尾氣.
解答 解:(1)苯和液溴在鐵作催化劑的條件下生成溴苯和HBr,所以燒瓶a中裝的試劑是溴、苯、鐵粉,故答案為:溴、苯、鐵粉;
(2)苯與液溴發生取代反應,生成溴苯和HBr,由于反應放熱,溴、苯沸點低,易揮發,所以從導管導出的氣體中可能含有一定的溴和苯.故長導管的作用為導氣兼冷凝、回流反應物,
故答案為:導氣,冷凝、回流反應物;
(3)反應生成了溴化氫溶于水中電離出溴離子和銀離子,加入硝酸銀反應生成淡黃色沉淀溴化銀,說明溴單質和苯的反應是發生了取代反應,苯是無色、密度大于水的液體,
故答案為:淡黃色沉淀;取代反應;無;重;
(4)冷凝水的流動方向應自下而上,這樣的冷卻效果好,確保充分冷卻,反應尾氣中有揮發的溴和生成的溴化氫,能污染空氣,所以要用堿石灰吸收尾氣,
故答案為:自下而上;吸收多余HBr氣體,防止空氣污染.
點評 本題主要考查了苯的性質實驗,掌握反應的原理、各物質的性質以及操作的方法是解題的關鍵,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題

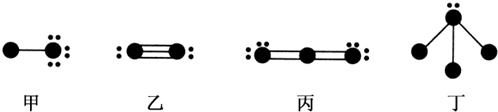
| A. | 通常狀況下在水中溶解度丙大于丁 | |
| B. | 甲、乙、丙為非極性分子,丁為極性分子 | |
| C. | 甲的水溶液中存在4種氫鍵 | |
| D. | 甲中電負性小的元素與丙中電負性大的元素形成的化合物一定不存在極性鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 逆反應速率增大,正反應速率減小 | B. | 逆反應速率減小,正反應速率增大 | ||
| C. | 正、逆反應速率都減小 | D. | 正、逆反應速率都增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某學習小組為探究部分元素化合物的性質,設計了下面的實驗裝置:
某學習小組為探究部分元素化合物的性質,設計了下面的實驗裝置:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 開始沉淀時 | 3.4 | 6.3 | 1.5 |
| 完全沉淀時 | 4.7 | 8.3 | / |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 1、2-二溴乙烷可作汽油抗爆劑,常溫下它是無色液體,密度2.18g/cm3,沸點131.4 0C,不溶于水,易溶于醇、醚、丙酮等有機溶劑.在實驗室可以用下圖所示裝置制備1、2-二溴乙烷,其中分液漏斗和燒瓶a中裝有乙醇和濃硫酸的混合液,試管c中裝有濃溴水.
1、2-二溴乙烷可作汽油抗爆劑,常溫下它是無色液體,密度2.18g/cm3,沸點131.4 0C,不溶于水,易溶于醇、醚、丙酮等有機溶劑.在實驗室可以用下圖所示裝置制備1、2-二溴乙烷,其中分液漏斗和燒瓶a中裝有乙醇和濃硫酸的混合液,試管c中裝有濃溴水.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知苯甲酸乙酯的沸點為213℃(在此溫度以下水、乙醇和環己烷以7.0%、17.0%、76.0%的比例成為蒸汽逸出).請回答上述實驗室制備苯甲酸乙酯的有關問題:
已知苯甲酸乙酯的沸點為213℃(在此溫度以下水、乙醇和環己烷以7.0%、17.0%、76.0%的比例成為蒸汽逸出).請回答上述實驗室制備苯甲酸乙酯的有關問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某學校化學興趣小組以在不同的溫度下淀粉遇碘變藍色的快慢為背景來研究溫度對化學反應速率影響.具體研究過程:
某學校化學興趣小組以在不同的溫度下淀粉遇碘變藍色的快慢為背景來研究溫度對化學反應速率影響.具體研究過程:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com