
| A. | NaBH4的電子式為 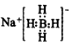 | |
| B. | 該反應在無水環境中進行 | |
| C. | NaBH4是很好的還原劑,常用于有機合成 | |
| D. | 1 molNaBH4與水充分反應可生成標況下44.8LH2 |
分析 A.根據NaBH4為離子化合物書寫;
B.根據NaH及易與水反應生成氫氧化鈉和氫氣判斷;
C.NaBH4中H元素的化合價為-1價易升高,所以NaBH4是很好的還原劑;
D.根據NaBH4中H元素的化合價為-1價與水充分反應氫氣化合價變化為1計算.
解答 解:A.NaBH4為離子化合物,電子式為 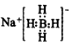 ,故A正確;
,故A正確;
B.反應物NaH及易與水反應生成氫氧化鈉和氫氣,所以在無水環境中進行,故B正確;
C.NaBH4中H元素的化合價為-1價易升高,所以NaBH4是很好的還原劑,常用于有機合成,故C正確;
D.NaBH4中H元素的化合價為-1價與水充分反應氫氣化合價變化為1,則1molNaBH4與水充分反應可生成標況下1mol×4×22.4L/mol=89.6L,故D錯誤;
故選D.
點評 本題考查電子式的書寫、NaH和NaBH4中性質等,注意NaH、NaBH4中H元素的化合價是-1價,會根據化合價的變化計算,難度不大.


科目:高中化學 來源: 題型:填空題
 (1)對于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(寫表達式).
(1)對于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(寫表達式).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 常溫下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及導電能力與加入氨水體積的關系如圖.下列說法不正確的是( )
常溫下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及導電能力與加入氨水體積的關系如圖.下列說法不正確的是( )| A. | 常溫下,電離平衡常數Ka(HR)≈Kb(NH3•H2O) | |
| B. | b點溶液pH=7,此時HR溶液與氨水恰好完全反應 | |
| C. | c點溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a、b、c三點中,c點NH3•H2O的電離程度最大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
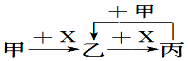 已知甲、乙、丙、X是4種中學化學中常見的物質,其轉化關系符合圖.則甲和X(要求甲和X能互換)不可能是( )
已知甲、乙、丙、X是4種中學化學中常見的物質,其轉化關系符合圖.則甲和X(要求甲和X能互換)不可能是( )| A. | C和O2 | B. | CO2和NaOH溶液 | ||
| C. | Cl2和Fe | D. | AlCl3溶液和NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 大量排放含氮、磷的生活污水可使水體富營養化 | |
| B. | “曾青得鐵,則化為銅”是描述金屬間的置換反應 | |
| C. | 光化學姻霧的形成主要與硫氧化物的排放有關 | |
| D. | 硅是光伏太陽能電池的光電半導體材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗事制氫氣時,加入少量NaNO3固體,不影響反應速率 | |
| B. | 鋅片分別與等pH的醋酸、硫酸反應,平均反應速率相等 | |
| C. | 升高溫度后,吸熱反應的速率加快,放熱反應的速率減慢 | |
| D. | 納米鐵粉在空氣中自燃,是因為納米鐵粉的表面積大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L的CH3Cl中所含質子數為26NA | |
| B. | 將100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3膠粒的數目為0.01NA | |
| C. | 常溫下,1L0.1mol/L醋酸中含有的離子總數為0.2NA | |
| D. | 0.1molC2H2氣體中,原子間含有的共用電子對數目為0.3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 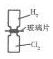 利用如圖裝置可將H2和Cl2均勻混合 | |
| B. | 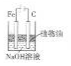 利用如圖裝置可以制備能較長時間存在的Fe(OH)2沉淀 | |
| C. |  利用如圖裝置加熱蒸干NaCl溶液制備NaCl晶體 | |
| D. |  利用如圖裝置分離苯和甲苯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①發生了氧化還原反應 | |
| B. | ①變灰暗是因為生成了過氧化鈉 | |
| C. | ③是碳酸鈉吸收空氣中的水蒸氣形成了溶液 | |
| D. | ④⑤只發生物理變化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com