實驗證明,純硫酸的導電性顯著強于純水.又知液態純酸都像水那樣進行自身電離(H2O+H2O?H3O++OH-)而建立平衡,且在一定溫度下都有各自的離子積常數.據此回答:
(1)純硫酸在液態時自身電離方程式是______.
(2)25℃時,液態純硫酸的離子積常數K(H2SO4)______1×10-14(填“>”“<”或“=”)
(3)已知Ksp[Cu(OH)2]=2×10-20,要使0.2mol/L溶液中的Cu2+沉淀較為完全(使Cu2+濃度降低至原來的千分之一),則應向溶液里加入NaOH溶液,使溶液pH為______.
解:(1)根據水的自身電離方程式,可以得出:純硫酸在液態時自身電離方程式是2H
2SO
4,?H
3SO
4++HSO
4-,故答案為:2H
2SO
4,?H
3SO
4++HSO
4-;
(2)純硫酸的導電性顯著強于純水,所以25℃時,液態純硫酸的離子積常數K(H
2SO
4)>1×10
-14,故答案為:>;
(3)Cu
2+沉淀較為完全是的濃度為
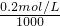
=2×10
-4mol/L,
則c(OH
-)=
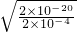
mol/L═10
-8mol/L,
則c(H
+)=
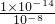
mol/L=10
-6mol/L,
所以pH=-lg(10
-6)=6,故答案為:6.
分析:(1)根據信息液態純酸都像水那樣進行自身電離:H
2O+H
2O?H
3O
++OH
-,結合電離方程式的書寫方法來回答;
(2)離子積常數K越大,電離程度越強;
(3)根據K
sp=c(Cu
2+)?[c(OH
-)]
2=2×10
-20,根據Cu
2+離子的濃度計算OH
-離子的濃度,根據水的離子積常數計算氫離子濃度,并以此計算溶液pH值.
點評:本題考查學生電解質在水中的電離以及難容電解質的溶解平衡知識,注意知識的梳理和歸納是解題的關鍵,難度不大.

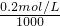 =2×10-4mol/L,
=2×10-4mol/L,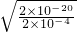 mol/L═10-8mol/L,
mol/L═10-8mol/L,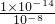 mol/L=10-6mol/L,
mol/L=10-6mol/L,
