
【題目】回答或解釋下列問題:
(1)已知:P4(白磷,s) =4P(紅磷,s) ΔH=-a kJ·mol-1(a>0),則穩定性:白磷_______紅磷(填“大于”或“小于”)。
(2)在常溫常壓下,1 g 氫氣在足量氯氣中完全燃燒生成氯化氫氣體,放出91.5 kJ 的熱量。寫出相應的熱化學方程式為____________;
(3)將濃氨水滴入到固體氫氧化鈉中,可以快速制備氨氣,用平衡移動原理解釋原因:____________;
(4)常溫下,用0.1mol·L-1 NaOH溶液分別滴定20.00 mL 0.1mol/L HCl溶液和20.00 mL0.1 mol/L CH3COOH溶液,得到2條滴定曲線如圖所示:
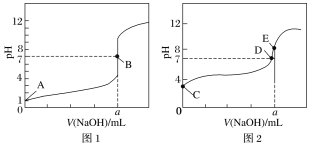
①由A、C點判斷,滴定HCl溶液的曲線是__________(填“圖1”或“圖2”)。
②a=________ mL。
③D點對應離子濃度由大到小的順序為____________。
【答案】小于 H2(g)+Cl2(g)=2HCl(g) ΔH=-183kJ·mol-1 在氨水中存在平衡:NH3+H2ONH3·H2ONH![]() +OH—,加入固體氫氧化鈉中,溶解放熱并電離出大量的OH—,平衡逆向移動,析出氨氣 圖1 20.00 c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
+OH—,加入固體氫氧化鈉中,溶解放熱并電離出大量的OH—,平衡逆向移動,析出氨氣 圖1 20.00 c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
【解析】
(1)物質具有的能量越低,越穩定;
(2) 在常溫常壓下,1 g 氫氣在足量氯氣中完全燃燒生成氯化氫氣體,放出91.5 kJ 的熱量,據此書寫反應的熱化學方程式;
(3)氨水中存在NH3+H2ONH3·H2O NH![]() +OH-的平衡關系,結合NaOH溶解放熱且發生電離分析解答;
+OH-的平衡關系,結合NaOH溶解放熱且發生電離分析解答;
(4)HCl是強酸、CH3COOH是弱酸,且均為一元酸,結合反應的方程式和電荷守恒分析解答。
(1)已知:P4(白磷,s)=4P(紅磷,s),△H<0,為放熱反應,說明白磷的能量比紅磷高,則紅磷比白磷穩定,故答案為:小于;
(2)在常溫常壓下,1 g 氫氣在足量氯氣中完全燃燒生成氯化氫氣體,放出91.5 kJ 的熱量,1mol氫氣為2g,則1mol氫氣在足量氯氣中完全燃燒生成氯化氫氣體,放出91.5 kJ×2=183kJ的熱量,熱化學方程式為H2(g)+Cl2(g)=2HCl(g) △H=-183kJ/mol,故答案為:H2(g)+Cl2(g)=2HCl(g)△H=-183kJmol-1;
(3)NH3+H2ONH3·H2ONH![]() +OH-,NaOH溶于水,放熱且發生電離,導致溶液中氫氧根離子濃度增大,平衡向生成氨氣的方向移動,溫度升高,促進分解NH3·H2O,使得氨氣逸出,故答案為:在氨水中存在平衡:NH3+H2ONH3·H2ONH
+OH-,NaOH溶于水,放熱且發生電離,導致溶液中氫氧根離子濃度增大,平衡向生成氨氣的方向移動,溫度升高,促進分解NH3·H2O,使得氨氣逸出,故答案為:在氨水中存在平衡:NH3+H2ONH3·H2ONH![]() +OH—,加入固體氫氧化鈉中,溶解放熱并電離出大量的OH—,平衡逆向移動,析出氨氣;
+OH—,加入固體氫氧化鈉中,溶解放熱并電離出大量的OH—,平衡逆向移動,析出氨氣;
(4)①HCl是強酸、CH3COOH是弱酸,濃度相同的HCl和CH3COOH的pH:HCl<CH3COOH,根據圖知,未加NaOH時,pH較小的是圖1,所以圖1是滴定鹽酸的曲線,故答案為:圖1;
②酸和堿都是一元的,則酸堿以物質的量之比為1∶1進行反應,酸堿的物質的量濃度相等,酸堿恰好中和時其物質的量相等,則酸堿溶液的體積相等,圖1中pH=7說明酸堿恰好完全反應生成強酸強堿鹽NaCl,二者的體積相等,為20.00mL,故答案為:20.00;
③D點為CH3COOH和NaOH反應后溶液的pH=7的點,溶液中溶質為CH3COONa和CH3COOH,溶液呈中性,則c(OH-)=c(H+),根據電荷守恒,c(Na+)+ c(H+)=c(CH3COO-)+c(OH-),則c(Na+)=c(CH3COO-),因此c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故答案為:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)。


科目:高中化學 來源: 題型:
【題目】CuSO4是一種重要的化工原料,其有關制備途徑如圖所示。下列說法正確的是

A. 途徑①所用混酸中H2SO4與HNO3物質的量之比最好為2∶3
B. 利用途徑③制備16g硫酸銅,消耗硫酸的物質的量為0.1mol
C. 生成等量的硫酸銅,三個途徑中參加反應的硫酸的物質的量:①=②=③
D. 與途徑①、③相比,途徑②更好地體現了綠色化學思想
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是 ( )
A.漂白粉溶液中通入過量的CO2:Ca2+ +2ClO- + CO2 +H2O = CaCO3↓+2HClO
B.實驗室用MnO2和濃鹽酸制取Cl2:MnO2 + 4HCl(濃)![]() Mn2+ +2Cl- + Cl2↑ + 2H2O
Mn2+ +2Cl- + Cl2↑ + 2H2O
C.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3- + Ba2+ + OH-= BaCO3↓+ H2O
D.鈉和冷水反應:Na + 2H2O = Na+ + H2↑+ 2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據氧化還原反應:2Ag++Cu=Cu2++2Ag設計的原電池如圖所示。請回答下列問題:

(1)電極X的材料是________;
(2)X電極發生的電極反應式為____________________;銀電極上發生的電極反應為________(填“氧化”或“還原”)反應。
(3)外電路中的電子________(填“流出”或“流向”)Ag電極。
(4)當有3.2 g銅溶解時,銀電極增重________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】潔凈安全的生存環境:2012年3月,新《環境空氣質量標準》的頒布表明國家對環境問題的進一步重視。
(1)煤燃燒產生的SO2所形成的酸雨中,SO2最終轉化成的酸是___(填化學式)。在煤中加入適量___,可以大大減少煤燃燒時SO2的排放,該反應的化學方程式為:___。
(2)A、B、C三個城市全年雨水的月平均pH變化如圖所示。
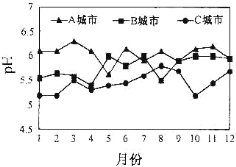
①受酸雨危害最嚴重的是___城市。
②汽車尾氣中含有NO2、NO、CO等有害氣體。汽車安裝尾氣凈化裝置可將NO、CO轉化為無害氣體。寫出該反應的化學方程式:___。
③自來水生產過程中要經過:去除固體雜質和懸浮物、消毒、去除異味等一系凈化工序。天然水中雜質較多,常需加入明礬,ClO2等物質處理后才能飲用:加入ClO2的作用是___;加入明礬后,Al3+水解生成的___(填化學式)膠體能吸附水中的懸浮顆粒,并使之沉降。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用如圖所示裝置進行以下實驗,能得到相應實驗結論的是
① | ② | ③ | 實驗結論 |
| |
A | 濃氨水 | NaOH | 酚酞 | NaOH的堿性比 NH3H2O的強 | |
B | 濃鹽酸 | MnO2 | 淀粉溶液 | 非金屬性:氯元素大于碘元素 | |
C | 濃硝酸 | Na2CO3 | Na2SiO3 | 酸性:HNO3 > H2CO3 > H2SiO3 | |
D | 濃硫酸 | 蔗糖 | 溴水 | 濃硫酸具有脫水性、氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學興趣小組探究SO2與FeCl3溶液的反應,裝置如下圖所示。
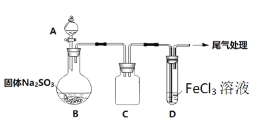
已知:
i.Fe(HSO3)2+離子為紅棕色,它可以將Fe3+還原為Fe2+。
ii.生成Fe(HSO3)2+離子的反應為:Fe3+ +HSO![]() Fe(HSO3)2+ 。
Fe(HSO3)2+ 。
步驟一:實驗準備:
如上圖連接裝置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用鹽酸酸化),測其pH約為1,取少量裝入試管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃儀器為燒杯、玻璃棒、膠頭滴管和______,裝置C的作用為:________________。
(2)用離子方程式解釋1.0 mol·L-1 FeCl3溶液(未用鹽酸酸化)pH=1的原因:________
步驟二:預測實驗
(3)該小組同學預測SO2與FeCl3溶液反應的現象為溶液由棕黃色變成淺綠色。
該小組同學預測的理論依據為:________________
步驟三:動手實驗
(4)當SO2通入到FeCl3溶液至飽和時,同學們觀察到的現象是溶液由棕黃色變成紅棕色,將混合液放置12小時,溶液才變成淺綠色。
①SO2與FeCl3溶液反應生成了Fe(HSO3)2+離子的實驗證據為:__________。證明淺綠色溶液中含有Fe2+的實驗操作為:_____________ 。
②為了探究如何縮短紅棕色變為淺綠色的時間,該小組同學進行了如下實驗。
實驗I | 往5mL1mol·L-1 FeCl3溶液中通入SO2氣體,溶液立即變為紅棕色。微熱3 min,溶液顏色變為淺綠色。 |
實驗II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用濃鹽酸酸化)中通入SO2氣體,溶液立即變為紅棕色。幾分鐘后,發現溶液顏色變成淺綠色。 |
綜合上述實驗探究過程,得出的結論為:____________。
步驟四:反思實驗:
(5)在制備SO2的過程中,同學們發現,使用70%的硫酸比用98%的濃硫酸反應速率快,分析其中的原因是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定穩定下,在容積不變的密閉容器中,進行如下可逆反應:![]() ,下列能表明該反應已達到平衡狀態的是
,下列能表明該反應已達到平衡狀態的是
①![]()
②![]()
③![]()
④混合氣的密度保持不變
⑤混合氣體的平均摩爾質量不變
A.僅④B.僅④⑤
C.僅①④D.僅③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為氯堿工業的簡易裝置示意圖,其中兩電極均為惰性電極,下列說法正確的是
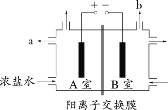
A.粗鹽水中含有的少量 Ca2+和 Mg2+均可用 NaOH 除去
B.若電路中通過 0.2 mol 電子,理論上可在 b 處得到標準狀況下 1.12 L 氣體
C.a 處得到的是濃 NaOH 溶液
D.適當降低陽極電解液的 pH 有利于 Cl2 逸出
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com