
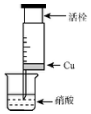
 某研究性學習小組設計不同實驗方案來研究硝酸的性質.
某研究性學習小組設計不同實驗方案來研究硝酸的性質.| 組 | m(Cu)/g | 硝酸(過量) | 溶液顏色 |
| A | 1 | 濃HNO3(4mL) | 溶液為綠色 |
| 1 | 稀HNO3(4mL) | 溶液為藍色 | |
| B | 0.5 | 濃HNO3(4mL) | 溶液為綠色 |
| 1 | 稀HNO3(4mL) | 溶液為藍色 | |
| C | 2 | 濃HNO3(4mL) | 溶液為綠色 |
| 1 | 稀HNO3(4mL) | 溶液為藍色 |
分析 (1)硝酸具有強氧化性,能氧化單質銅生成硝酸銅,溶液呈藍色,要驗證NO,可利用其極易被氧氣氧化生成紅棕色二氧化氮來實現;
(2)因為反應中硝酸過量,而銅的質量也是相等的,即生成的硝酸銅的濃度是相同的,說以不可能是因為濃度差異引起,由于硝酸過量,而硝酸是不穩定的,在加熱的條件下,硝酸也會分解生成二氧化氮,在氧氣的作用下,生成硝酸,由于消耗了二氧化氮,所以溶液顏色顯藍色,根據原理可知方案1和3均引起環境污染,說以方案2是最好的.
解答 解:(1)①硝酸具有強氧化性,與銅反應生成硝酸銅,稀硝酸生成NO,NO氣體無色,化學方程式為:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
故答案為:無;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
②要驗證NO,可利用其極易被氧氣氧化生成紅棕色二氧化氮來實現,方法是往針筒內抽氣,氣體由無色變紅棕色;
故答案為:往針筒內抽氣,氣體由無色變紅棕色;
(2)①因為反應中硝酸過量,而銅的質量也是相等的,即生成的硝酸銅的濃度是相同的;
故答案為:不同意;相同質量的銅與相同體積且過量的硝酸反應生成的銅離子濃度相同;
②硝酸是不穩定的,在加熱的條件下,硝酸也會分解生成二氧化氮,二氧化氮和與氧氣反應生成硝酸,反應的方程式為4NO2+O2+2H2O=4HNO3;
故答案為:過量的硝酸分解會產生紅棕色的NO2;4NO2+O2+2H2O=4HNO3;
③方案一和三均引起環境污染,說以方案二是最好的;
故答案為:方案二.
點評 本題考查了銅與硝酸的反應,綜合考查學生實驗設計和探究能力,涉及硝酸的性質、物質驗證性實驗設計,利用對比的方法判斷硝酸的性質,題目難度中等,側重于考查學生的分析問題和解決問題的能量,注意相關基礎知識的學習與積累.


 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用滴定管前要檢查是否漏液 | |
| B. | 用簡易量熱計測定反應熱時,用環形玻璃攪拌棒進行攪拌使酸和堿充分反應,以達到良好的實驗效果 | |
| C. | 用精密pH試紙測得某濃度氯水的pH為3.5 | |
| D. | 燃料電池實驗中,用KNO3溶液或Na2SO4溶液代替蒸餾水,效果要好得多 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑥⑦ | B. | ①②④③⑥ | C. | ①⑥⑦ | D. | ①⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2 | B. | 2:3 | C. | 3:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,11.2L CHCl3含有的原子總數為2.5NA | |
| B. | 25g質量分數為68%的H2O2溶液中含有氧原子數目為NA | |
| C. | 高溫下,16.8gFe與足量水蒸氣完全反應失去0.8NA個電子 | |
| D. | 1molCH5+中含有的電子數目為11NA |
查看答案和解析>>
科目:高中化學 來源:2017屆山東省高三上第一次教學診斷化學卷(解析版) 題型:選擇題
分類是化學學習與研究的常用方法,下列分類正確的是
A.Cl2O7、P2O5、SO3、CO2均屬于酸性氧化物
B.Na2O、Na2O2為相同元素組成的金屬氧化物,都屬于堿性氧化物
C.根據是否具有丁達爾效應,將分散系分為溶液、濁液和膠體
D.根據溶液導電能力強弱,將電解質分為強電解質、弱電解質
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com