
(2010?祁陽縣一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大氣的主要污染物,綜合治理其污染是環境化學當前的重要研究內容之一.
(1)硫酸生產中,SO
2催化生成SO
3:2SO
2(g)+O
2(g)═2SO
3(g),反應過程的能量變化如圖所示.
①圖中A表示
反應物總能量
反應物總能量
.
②該反應通常用V
2O
5作催化劑,加V
2O
5對圖中E的大小有何影響?
降低
降低
(填“增大”、“降低”、“沒有”).
③在一定條件下,將0.100molSO
2(g)和0.060molO
2(g)放入容積為2L的密閉容器中,反應達到平衡時,測得c(SO
3)=0.04mol/L.則該條件下反應的平衡常數K=
1.6×103
1.6×103
.
(2)一定條件下,氫氣與一氧化碳按一定比例可生成潔凈能源甲醇(CH
3OH),則:
①n(H
2):n(CO)=
2:1
2:1
.
②甲醇高效燃料電池是以CH
3OH為燃料,O
2為氧化劑,KOH為電解質組成.該電池放電時,負極反應式為:
CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
.
(3)汽車尾氣是城市空氣的污染源之一,治理的方法之一是在汽車的排氣管上裝一個“催化轉換器”(用鉑、鈀合金作催化劑),它的特點是使CO和NO反應,生成可參與大氣生態循環的無毒氣體.
①寫出一氧化碳與一氧化氮反應的化學方程式:
2CO+2NO═2CO2+N2
2CO+2NO═2CO2+N2
.
②用CH
4催化還原NOx也可以消除氮氧化物的污染.例如:
CH
4(g)+4NO
2(g)═4NO(g)+CO
2(g)+2H
2O(g)△=-574kJ/mol
CH
4(g)+4NO(g)═2N
2(g)+CO
2(g)+2H
2O(g)△=-1160kJ/mol
若用標準狀況下6.72LCH
4還原NO
2到N
2,整個過程中轉移電子總數為
2.4NA
2.4NA
(阿伏加德羅常數的值用N
A表示),放出的熱量為
260.1
260.1
kJ.

 (2010?祁陽縣一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大氣的主要污染物,綜合治理其污染是環境化學當前的重要研究內容之一.
(2010?祁陽縣一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大氣的主要污染物,綜合治理其污染是環境化學當前的重要研究內容之一.

 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案 (2010?祁陽縣一模)根據如圖表示的一些物質或概念間的從屬關系,下列各項中不正確的是:( )
(2010?祁陽縣一模)根據如圖表示的一些物質或概念間的從屬關系,下列各項中不正確的是:( )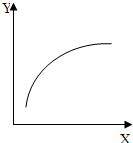 (2010?祁陽縣一模)在一密閉器中通入N2和H2,在一定條件下發生反應:N2+3H2═2NH3△<0,達到平衡后,只改變其中一個條件(X),下 量(Y)的變化一定符合圖中曲線的是:( )
(2010?祁陽縣一模)在一密閉器中通入N2和H2,在一定條件下發生反應:N2+3H2═2NH3△<0,達到平衡后,只改變其中一個條件(X),下 量(Y)的變化一定符合圖中曲線的是:( )