
 (1)高鐵電池是一種新型可充電電池,與普通電池相比,該電池能較長時間保持穩定的放電電壓.高鐵電池的總反應為:3Zn+2K2FeO4+8H2O $?_{充電}^{放電}$3Zn(OH)2+2Fe(OH)3+4KOH. 請回答下列問題:
(1)高鐵電池是一種新型可充電電池,與普通電池相比,該電池能較長時間保持穩定的放電電壓.高鐵電池的總反應為:3Zn+2K2FeO4+8H2O $?_{充電}^{放電}$3Zn(OH)2+2Fe(OH)3+4KOH. 請回答下列問題:分析 (1)①放電時,該電池是原電池,原電池負極上失電子化合價升高而發生氧化反應;
②放電時,正極上得電子發生還原反應,總反應方程式減去負極電極反應式即得正極反應式;
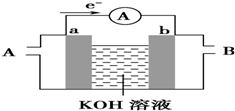
(2)①堿性條件下,電子由a流向b,則a為負極,b為正極,a電極上為甲烷失電子生成碳酸根離子;b電極上為氧氣得電子生成氫氧根離子;
②根據負極上的反應,消耗負極質量減少一樣多時,轉移得電子的物質的量即可.
解答 解:(1)①電池的負極上發生氧化反應,正極上發生還原反應.由高鐵電池放電時總反應方程式可知,負極材料應為作還原劑的Zn,故答案為:鋅;
②正極上得電子發生還原反應,由電池的總反應方程式-負極反應式=正極反應式可知,正極反應式為FeO42-+3e-+4H2O═Fe(OH)3+5OH-,
故答案為:還原;FeO42-+3e-+4H2O═Fe(OH)3+5OH-;
(2)①堿性條件下,電子由a流向b,則a為負極,b為正極,a電極上為甲烷失電子生成碳酸根離子,其電極反應式為:CH4+10OH--8e-═CO32-+7H2O;
b電極上為氧氣得電子生成氫氧根離子,其電極反應式為:2O2+4H2O+8e-═8OH-;
故答案為:CH4+10OH--8e-═CO32-+7H2O;2O2+4H2O+8e-═8OH-;
②根據負極上的電極反應式:CH4+10OH--8e-═CO32-+7H2O,鉛蓄電池的負極上發生的反應為:Pb-2e-+SO42-=PbSO4,
所以當兩種電池提供相同電量時,負極所消耗物質的物質的量之比為:1:4,故答案為:1:4.
點評 本題考查了原電池原理等知識,明確正負極上得失電子及反應類型是解本題關鍵,難點是電極反應式的書寫.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,2.0 g氟化氫所含電子數為0.1NA | |
| B. | 1 mol Na2O2 跟足量H2O反應時得到電子的數目為2NA | |
| C. | 標準狀況下,11.2 L二氯甲烷所含分子數為0.5NA | |
| D. | 現有乙烯、丙烯、丁烯的混合氣體共14 g,其原子數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同主族元素含氧酸的酸性隨核電荷數的增加而減弱 | |
| B. | 核外電子排布相同的微粒化學性質也相同 | |
| C. | Cl?、S2?、Ca2+、K+半徑逐漸減小 | |
| D. | 35Cl2與37Cl2得電子能力相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ),并且乙烯基和次甲基之間必須通過亞甲基相連,當該烴含有單環結構是分子中的乙烯基和亞甲基的個數依次為( )
),并且乙烯基和次甲基之間必須通過亞甲基相連,當該烴含有單環結構是分子中的乙烯基和亞甲基的個數依次為( )| A. | 2個,3個 | B. | 5個,3個 | C. | 4個,6個 | D. | 3個,6個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③④ | C. | ②③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com