
Ⅰ、工業上設計用CO2來生產燃料甲醇,既減少二氧化碳氣體,又得到寶貴的能源物質。為了探究反應原理,現進行如下實驗:在體積為1L的密閉容器中,充入1molCO2和3molH2,某溫度下發生反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0KJ/mol.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示
CH3OH(g)+H2O(g)△H=-49.0KJ/mol.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示
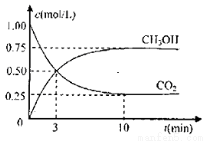
(1)該反應該溫度下,化學平衡常數的值為_______________________
(2)下列說法中能作為反應達到平衡狀態標志的是___________________(填字母)。
A.容器內壓強不再發生變化
B.平均相對分子質量不再變化
C.c(CO2)和c(H2)之比等于1:3
D.相同時間內每斷裂3molH-H鍵,同時斷裂3molO-H鍵
(3)下列措施中能使n(CH3OH)/n(CO2)減小的是__________________
A.再充入1molCO2和3molH2 B.將H2O(g)從體系中分離
C.充入He(g),使體系壓強增大 D.升高溫度
Ⅱ、鋼鐵工業是國家工業的支柱,每年鋼鐵生銹讓國家損失大量資金,請回答鋼鐵腐蝕與防護過程中的有關問題。
(1)在實際生產中,可在鐵件的表面鍍銅防止鐵被腐蝕。裝置示意圖如下:

①A電極對應的金屬是_________(寫元素名稱),B電極的電極反應式是__________;
②若電鍍前鐵、銅兩片金屬質量相同,電鍍完成后將它們取出洗凈、烘干、稱量,二者質量差為5.12g,則電鍍時電路中通過的電子為__________;
③鍍層破損后,鍍銅鐵比鍍鋅鐵更容易被腐蝕,請簡要說明原因___________________________。
科目:高中化學 來源:2015-2016學年吉林省高二上期末考試化學試卷(解析版) 題型:選擇題
銅鋅原電池(如圖)工作時,下列敘述正確的是
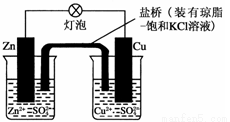
A.正極反應為:Zn-2e-=Zn2+
B.電池反應為:Zn+Cu2+=Zn2++Cu
C.當有1mol電子轉移時,鋅極減輕65g
D.鹽橋中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化學 來源:2016屆河北省衡水市高三上一輪復習檢測二化學試卷(解析版) 題型:選擇題
下列實驗誤差分析正確的是
A、用濕潤的pH試紙測稀堿液的pH,測定值偏大
B、用容量瓶配制溶液,定容時俯視刻度線,所配溶液濃度偏小
C、滴定前滴定管內無氣泡,終點讀數時有氣泡,所測體積偏小
D、測定中和反應反的應熱時,將堿緩慢倒入酸中,所測溫度值偏大
查看答案和解析>>
科目:高中化學 來源:2016屆河北省衡水市高三上一輪復習檢測一化學試卷(解析版) 題型:選擇題
純凈物X、Y、Z轉化關系如右圖所示,下列判斷正確的是( )
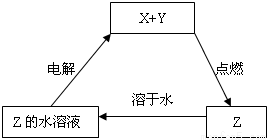
A.X可能是金屬銅
B.Y不可能是氫氣
C.Z可能是氯化鈉
D.Z可能是三氧化硫
查看答案和解析>>
科目:高中化學 來源:2016屆山西省高三上12月月考化學試卷(解析版) 題型:選擇題
一般情況下,前者無法決定后者的是( )
A.原子核外電子排布﹣﹣元素在周期表中的位置
B.弱電解質的相對強弱﹣﹣電離常數的大小
C.分子間作用力的大小﹣﹣分子穩定性的高低
D.物質內部儲存的能量﹣﹣化學反應的熱效應
查看答案和解析>>
科目:高中化學 來源:2016屆陜西省高三上期末化學試卷(解析版) 題型:選擇題
把VL含有MgSO4和K2SO4的混合溶液分成兩等份,一份加入含amolNaOH的溶液,恰好使鎂離子完全沉淀為氫氧化鎂;另一份加入含bmolBaCl2的溶液,恰好使硫酸根離子完全沉淀為硫酸根,則原混合溶液中鉀離子的濃度為( )
A.(b-a)/V mol•L-1 B.(2b-a)/V mol•L-1
C.2(b-a)/V mol•L-1 D.2(2b-a)/V mol•L-1
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河南省高一上期末考試化學試卷(解析版) 題型:選擇題
常溫下,下列溶液可以用鋁槽車裝運的是( )
A.氫氧化鈉溶液 B.濃鹽酸 C.濃硝酸 D.稀硝酸
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省高三上學期第二次質檢化學試卷(解析版) 題型:推斷題
我國從國外進口某原料經測定主要含有A、B、C、D、E五種前四周期元素,且原子序數依次增大。元素A、B、C、D、E的原子結構等信息如下:
元素 元素性質或原子結構
A 周期表中原子半徑最小的元素
B 原子核外有三種不同的能級且各個能級所填充的電子數相同
C 最外層p軌道半充滿
D 位于短周期,其原子的核外成對電子數是未成對電子數的3倍
E 位于ds區且原子的最外層電子數與A的相同
請回答下列問題(用A、B、C、D、E所對應的元素符號作答):
(1)B、C、D第一電離能由小到大為______________。
(2)E的二價離子的電子排布式為______________。
(3)A2B2D4常用作除銹劑,該分子中B的雜化方式為_______________;1 mol A2B2D4分子中含有σ鍵數目為____________。
(4)與化合物BD互為等電子體的陰離子化學式為________________(任寫一種)。
(5)B2A6、C2A4分子中均含有18個電子,它們的沸點相差較大,主要原因是__________________。
(6)BD2在高溫高壓下所形成晶體的晶胞如圖所示。一個該晶胞中含______________個D原子。
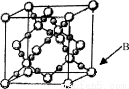
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com