
| A. | 在鐵件上鍍銅時,金屬銅作陽極 | |
| B. | 實驗室制氫氣用粗鋅比用純鋅速率快 | |
| C. | 電解精煉銅時,粗銅電極上每轉移0.2 mol e-,陰極析出6.4 g Cu(忽略能量損失) | |
| D. | 甲醇和氧氣以及KOH溶液構成的新型燃料電池中,負極反應為:CH3OH+6OH--6e-═CO2+5H2O |
分析 A、電鍍時,鍍層作陽極,鍍件作陰極;
B、根據原電池能加快化學反應速率來回答;
C、陽極材料為粗銅,有比銅活潑的金屬先放電,陰極上是銅離子得電子的還原反應;
D、甲醇燃料電池是堿性環境,負極是燃料失電子的氧化反應.
解答 解:A、電鍍銅時,銅作陽極,陽極上銅失電子發生氧化反應,鍍件作陰極,陰極上銅離子放電生成銅,故A正確;
B、鋅與硫酸反應生成氫氣,粗鋅和硫酸形成原電池,原電池能加快化學反應速率,故B正確;
C、陽極材料為粗銅,有比銅活潑的金屬先放電,粗銅電極上每轉移0.2mole-,陰極上是銅離子得電子發生還原反應,得到金屬銅是6.4g,故C正確;
D、甲醇和氧氣以及KOH溶液構成的新型燃料電池中,負極上發生的反應為:CH3OH+8OH--6e-═CO32-+6H2O,故D錯誤.
故選D.
點評 本題考查原電池,明確原電池的應用是解題的關鍵,題目難度不大.


 字詞句篇與同步作文達標系列答案
字詞句篇與同步作文達標系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 產物B的狀態只能為固態或液態 | |
| B. | 平衡時,單位時間內n(A)消耗﹕n(C)消耗=1﹕1 | |
| C. | 若開始時向容器中加入1molB和1molC,達到平衡時放出熱量等于Q kJ | |
| D. | 保持體積不變,向平衡體系中加入A,平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
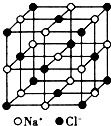 氟是非金屬性最強的元素.
氟是非金屬性最強的元素.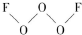 ,其中氧原子采用的軌道雜化方式是sp3,又如O2F2是一種強氧化劑,運用VSEPR模型判斷O2F2是極性(填“極性”或“非極性”)分子.
,其中氧原子采用的軌道雜化方式是sp3,又如O2F2是一種強氧化劑,運用VSEPR模型判斷O2F2是極性(填“極性”或“非極性”)分子.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡向正反應方向移動 | B. | x+y>z | ||
| C. | C的體積分數增大 | D. | B的轉化率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0mol•L-1 | B. | 0.8mol•L-1 | C. | 0.6mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
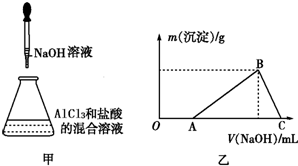 某同學稱取一定質量的AlCl3固體配成溶液,在該溶液中加入一定量的稀鹽酸,然后向此混合溶液中逐滴加入NaOH溶液如圖甲所示.滴加過程中產生沉淀的質量與加入NaOH溶液的體積的關系如圖乙所示.
某同學稱取一定質量的AlCl3固體配成溶液,在該溶液中加入一定量的稀鹽酸,然后向此混合溶液中逐滴加入NaOH溶液如圖甲所示.滴加過程中產生沉淀的質量與加入NaOH溶液的體積的關系如圖乙所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
| 溫度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com