
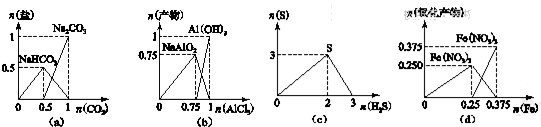
| A. | 圖(a):n(NaOH)═1 mol時,CO2和NaOH溶液反應生成的鹽 | |
| B. | 圖(b):n(NaOH)═3 mol時,AlCl3溶液和NaOH 溶液反應的產物 | |
| C. | 圖(c):n(H2S)+n(SO2)═3 mol時,H2S與SO2反應生成的S | |
| D. | 圖(d):n(HNO3)═1 mol時,Fe和稀HNO3反應生成的氧化產物(還原產物為NO) |
分析 A.CO2逐步通入到NaOH溶液中,發生CO2+2NaOH═Na2CO3+H2O、Na2CO3+H2O+CO2═2NaHCO3;
B.NaOH 溶液中逐漸加入AlCl3,開始NaOH過量,生成偏鋁酸鈉,NaOH完全反應后,偏鋁酸鈉與AlCl3溶反應生成氫氧化鋁沉淀;
C.H2S與SO2反應生成的S,H2S過量時,沉淀不減少;
D.Fe和稀HNO3反應時,鐵少量時發生Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,全部轉化為三價鐵后繼續加人鐵,則發生Fe+2Fe(NO3)3═3Fe(NO3)2.
解答 解:A.因開始堿過量,則發生CO2+2NaOH═Na2CO3+H2O,n(NaOH)=1mol時生成0.5molNa2CO3,再加人二氧化碳發生Na2CO3+H2O+CO2═2NaHCO3,則最終碳酸鈉減少為0,碳酸氫鈉生成1mol,圖象與反應不符,故A錯誤;
B.NaOH 溶液中逐漸加入AlCl3,開始NaOH過量,生成偏鋁酸鈉,3molNaOH與0.75molAlCl3完全反應生成0.75molNaAlO2,然后偏鋁酸鈉與AlCl3溶反應生成氫氧化鋁沉淀,0.75molNaAlO2與0.25molAlCl3恰好完全反應,故B正確;
C.H2S與SO2反應生成的S,由于S與H2S不反應,所以H2S過量時,沉淀不減少,故C錯誤;
D.因開始硝酸過量,則發生Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,n(HNO3)=1mol時生成0.25molFe(NO3)3,圖象與反應不符,故D錯誤;
故選B.
點評 本題考查化學反應與圖象的關系,把握圖象中的線、點的意義及對應的化學反應是解答本題的關鍵,并注意反應物的量對反應的影響來分析反應的產物,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制備AlCl3、FeCl3、CuCl2均不能采用將溶液直接蒸干的方法 | |
| B. | 三者的單質放置在空氣中均只生成氧化物 | |
| C. | 工業上,三者的單質目前都使用熱還原法制得 | |
| D. | 電解AlCl3、FeCl3、CuCl2的混合溶液時陰極上依次析出Cu、Fe、Al |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
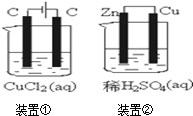
| A. | 兩個裝置中都發生了化學變化,都由化學能轉變為電能 | |
| B. | 裝置②中電流方向是從Zn經導線流入Cu | |
| C. | 反應開始階段,兩個裝置中均有氫氣產生 | |
| D. | 電極反應式:陽極2Cl--2e-→Cl2↑正極2H++2e-→H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HCl$\stackrel{催化劑}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 2C6H6+15O2$\stackrel{點燃}{→}$12CO2+6H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱的純堿溶液去除油污能力更強 | |
| B. | NaHCO3與Al2(SO4)3兩種溶液可作泡沫滅火器 | |
| C. | 保存FeSO4溶液時加入少量鐵粉 | |
| D. | 把AlCl3溶液加熱蒸干灼燒至質量不再變化得到Al2O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
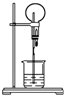 圖為化學實驗中常用的噴泉實驗裝置.在燒瓶中充滿干燥氣體,膠頭滴管及燒杯中分別盛有液體.下列組合中不可能形成噴泉的是( )
圖為化學實驗中常用的噴泉實驗裝置.在燒瓶中充滿干燥氣體,膠頭滴管及燒杯中分別盛有液體.下列組合中不可能形成噴泉的是( )| A. | SO2和H2O | B. | CO2和NaOH溶液 | C. | NH3和H2O | D. | NO和H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com