
化學在工農業生產和日常生活中都有重要應用。下列敘述正確的是( )
A.葡萄糖和蛋白質等高分子化合物是人體必需的營養物質
B.將草木灰和硫酸銨混合施用,肥效更高
C.用二氧化碳生產聚碳酸酯可以減少碳排放,以減緩溫室效應
D.棉花的主要成分是纖維素,石英玻璃、陶瓷和水泥均屬于硅酸鹽產品
 教學練新同步練習系列答案
教學練新同步練習系列答案 課前課后同步練習系列答案
課前課后同步練習系列答案 課堂小作業系列答案
課堂小作業系列答案科目:高中化學 來源:2015-2016學年遼寧省高二下期中化學試卷(解析版) 題型:選擇題
甲烷在高溫條件下可發生分【解析】
2CH4→C2H2+3H2,現使甲烷分解得到的混合物的氣體對氦的相對密度為2.5,則甲烷的分解率是:
A.50% B.60% C.70% D.80%
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二下期中化學試卷(解析版) 題型:填空題
如圖是由4個碳原子結合成的6種有機物(氫原子沒有畫出)。
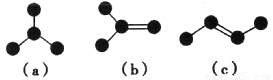
(1)寫出有機物(a)的系統命名法的名稱__________。
(2)有機物(a)有一種同分異構體,試寫出其結構簡式__________。
(3)上述有機物中與(c)互為同分異構體的是__________ (填代號).
(4)任寫一種與(e)互為同系物的有機物的結構簡式__________。
(5)上述有機物中不能與溴水反應但能使其褪色的有__________(填代號)。
(6) (a) (b) (c)三種物質中,4個碳原子一定處于同一平面的有________ (填代號)。
查看答案和解析>>
科目:高中化學 來源:2016屆江西省贛州市十三縣高三下期中理綜化學試卷(解析版) 題型:填空題
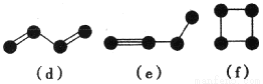
【化學—選修5:有機化學基礎】我國成功研制出丁苯酞,標志著我國在腦血管疾病治療藥物研究領域達到了國際先進水平。合成丁苯酞(J)的一種路線如下
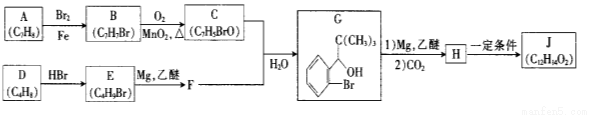
已知:①
②E的核磁共振氫譜只有一組峰;
③J是一種酯,分子中除苯環外還含有一個五元環。
回答下列問題:
(1)對E的系統命名
(2)由B生成C反應類型為
(3)C中官能團名稱為 ,C分子中最多有 個原子共平面。(已知甲醛中所有原子共面)
(4)由H生成J的化學方程式為 (寫明反應條件)。
(5)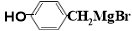 與CO2反應生成X,X的同分異構體中:
與CO2反應生成X,X的同分異構體中:
①能發生水解反應;②能發生銀鏡反應;③能與氯化鐵溶液發生顯色反應。
滿足上述條件X的同分異構體共有 種(不考慮超出中學范圍的順反異構和手性異構),寫出核磁共振氫譜圖中有五個吸收峰的同分異構體的結構簡式 。
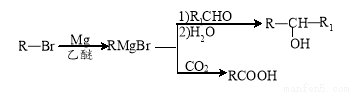
(6)參考題中信息和所學知識,寫出由甲醛和化合物A合成2一苯基乙醇( )的路線流程圖(其它試劑任選)。合成路線流程圖表達方法例如下:
)的路線流程圖(其它試劑任選)。合成路線流程圖表達方法例如下:
查看答案和解析>>
科目:高中化學 來源:2016屆江西省贛州市十三縣高三下期中理綜化學試卷(解析版) 題型:選擇題
二氯化二硫(S2C12)分子中的各原子最外層電子數均滿足8電子,易與水反應:
2S2Cl2+2H2O=4HCl+SO2↑+3S↓。對該反應下列說法正確的是( )
A.1molS2C12價電子數為66NA
B.氧化產物與還原產物的物質的量之比為l : 7
C.每生成l mol SO2轉移4 NA電子
D.每生成48g硫單質會斷裂5NA共價鍵
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省吉林市高三第三次調研理綜化學試卷(解析版) 題型:填空題
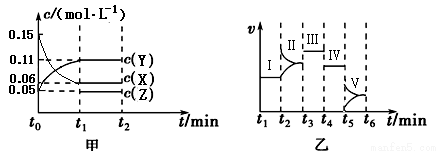
某實驗組為研究“不同條件”對化學平衡的影響情況,進行了如下實驗:一定條件下,向一個密閉容器中加入0.30molX、0.10molY和一定量的Z三種氣體,甲圖表示發生反應后各物質濃度(c)隨時間(t)的變化〔其中t0~t1階段c(Z)未畫出〕。乙圖表示化學反應速率(v)隨時間(t)的變化,四個階段都只改變一種條件(催化劑、溫度、濃度、壓強,每次改變條件均不同),已知t3~t4階段為使用催化劑。
回答下列問題:
(1)若t1=5 min,則t0~t1階段以X濃度變化表示的反應速率為v(X)= 。
(2)在t2~t3階段Y的物質的量減小,則此階段開始時v正 v逆(填“>”、“=”或“<”)。
(3)t4~t5階段改變的條件為 ,此階段的平衡常數K = 。
(4)t5~t6階段容器內Z的物質的量共增加0.10 mol,在反應中熱量變化總量為a kJ,寫出該反應的熱化學方程式 。在乙圖Ⅰ~Ⅴ處平衡中,平衡常數最大的是 。
(5)若起始實驗條件不變,重新向該容器中加入0.60 mol X、0.20 mol Y和0.080 mol Z,反應至平衡狀態后X的轉化率= 。
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省吉林市高三第三次調研理綜化學試卷(解析版) 題型:選擇題
分子式為C7H12O4,其中只含二個—COOCH3基團的同分異構體(不考慮手性異構)共有
A.4種 B.5種 C.6種 D.7種
查看答案和解析>>
科目:高中化學 來源:2016屆四川省邛崍市高三強化訓練一化學試卷(解析版) 題型:選擇題
在一定溫度下,將等量的氣體分別通入起始體積相同的密閉容器Ⅰ和Ⅱ中,使其發生反應,t0時容器Ⅰ中達到化學平衡,X、Y、Z的物質的量的變化如圖所示。則下列有關推斷正確的是( )

A.該反應的化學方程式為:3X+2Y 2Z
2Z
B.若兩容器中均達到平衡時,兩容器的體積V(Ⅰ)<V(Ⅱ),則容器Ⅱ達到平衡所需時間小于t0
C.若兩容器中均達到平衡時,兩容器中Z的物質的量分數相同,則Y為固態或液態
D.若達平衡后,對容器Ⅱ升高溫度時,其體積增大,說明Z發生的反應為吸熱反應
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏銀川市高三4月質檢理綜化學試卷(解析版) 題型:實驗題
鈦被稱為“二十一世紀金屬”,工業上用鈦鐵礦制備金屬鈦的工藝流程如下:
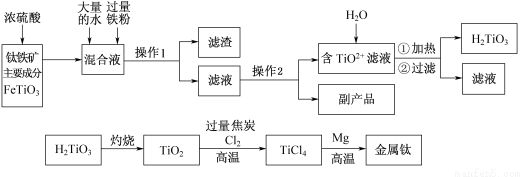
已知:鈦鐵礦主要成分與濃硫酸反應的主要產物是TiOSO4和FeSO4,TiOSO4遇水會水解。
請回答下列問題:
(1)操作1用到的玻璃儀器除燒杯外還有 ,操作2是 、過濾,副產品主要成分的化學式為 。
(2)請結合化學用語解釋將TiO2+轉化為H2TiO3的原理 。
(3)已知鈦的還原性介于鋁與鋅之間,估計鈦能耐腐蝕的原因之一是 。如果可從Na、Zn、Fe三種金屬中選一種金屬代替流程中的鎂,那么該金屬跟四氯化鈦反應的化學方程式是 。
(4)電解TiO2來獲得Ti是以TiO2作陰極,石墨為陽極,熔融CaO為電解質,用碳塊作電解槽,其陰極反應的電極反應式是 。
(5)為測定溶液中TiOSO4的含量,首先取待測鈦液10 mL用水稀釋至100 mL,加過量鋁粉,充分振蕩,使其完全反應:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。過濾后,取出濾液20.00 mL,向其中滴加2~3滴KSCN溶液作指示劑,用 (填一種玻璃儀器的名稱)滴加0.1000mol·L-1 FeCl3溶液,發生Ti3++Fe3+=Ti4++Fe2+。當溶液出現紅色達到滴定終點,用去了30.00mL FeC13溶液。待測鈦液中TiOSO4的物質的量濃度是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com