
| A. | NaHCO3在水溶液中水解:HCO3-+H2O?H3O++CO32- | |
| B. | 電解飽和食鹽水:C1-+2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+Cl2↑+OH- | |
| C. | 氫氧燃料電池在堿性介質中的正極反應式:O2+2H2O+4e一=4OH- | |
| D. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
分析 A.碳酸氫鈉溶液中碳酸氫根離子是弱酸陰離子溶液中水解是結合水電離出的氫離子,促進水電離平衡正向進行,選項中是碳酸氫根離子的電離方程式;
B.電解飽和食鹽水溶液是氯離子在陽極失電子生成氯氣,氫離子在陰極生成氫氣,反應是氯化鈉和水反應在通電條件下反應生成氫氧化鈉、氯氣和氫氣;
C.燃料電池中發生的氧化還原反應,燃料在負極失電子發生氧化反應,氧氣在正極得到電子發生還原反應,堿性環境中氧氣得到電子生成氫氧根離子;
D.選項中離子方程式中不符合電荷守恒;
解答 解;A.NaHCO3在水溶液中水解:HCO3-+H2O?OH-+H2CO3,HCO3-+H2O?H3O++CO32- 是碳酸氫根離子的電離方程式,把氫離子寫成了水合氫離子的形式,故A錯誤;
B.電解飽和食鹽水溶液是氯離子在陽極失電子生成氯氣,氫離子在陰極生成氫氣,反應是氯化鈉和水反應在通電條件下反應生成氫氧化鈉、氯氣和氫氣,反應的離子方程式為:C1-+2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+Cl2↑+2OH-,故B錯誤;
C.氧氣在正極得到電子發生還原反應,堿性環境中氧氣得到電子生成氫氧根離子,電電極反應O2+2H2O+4e一=4OH-,故C正確;
D.FeCl2溶液中通入Cl2離子方程式為:2Fe2++Cl2=2Fe3++2Cl-,故D錯誤;
故選C.
點評 本題考查了離子方程式書寫和正誤判斷,注意原電池中電極反應的書寫方法,正誤基礎是解題關鍵,題目難度中等.


 一卷搞定系列答案
一卷搞定系列答案 名校作業本系列答案
名校作業本系列答案 輕巧奪冠周測月考直通名校系列答案
輕巧奪冠周測月考直通名校系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
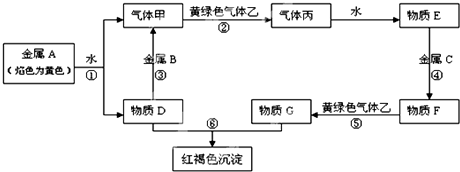
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同質量的N4、N5分子其原子數之比為5:4 | |
| B. | N5、N4與N2互為同素異形體 | |
| C. | N4、N5均屬于新型的化合物 | |
| D. | N5的摩爾質量為70 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化還原反應的實質是電子轉移 | B. | 氧化劑在反應中本身被還原 | ||
| C. | 氧化反應和還原反應同時進行 | D. | 氧化還原反應一定有單質參加 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
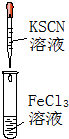 | 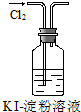 | 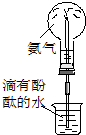 | 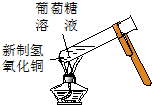 |
| ① | ② | ③ | ④ |
| A. | 實驗①試管中混合溶液中出現紅色沉淀 | |
| B. | 實驗②中溶液變黃色 | |
| C. | 實驗③中燒瓶內溶液變紅色 | |
| D. | 實驗④中出現黑色氧化銅固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
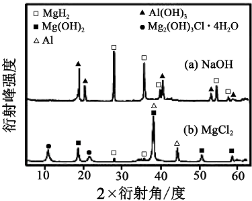
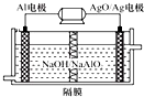
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com