
【題目】將濃度均為0.5molL-1氨水和KOH溶液分別滴入到體積均為20mL且濃度相同的AlCl3溶液中,測得溶液的導電率與加入堿的體積關系如圖所示,下列說法中錯誤的是( )
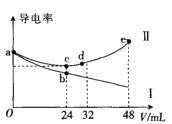
A.AlCl3溶液的物質的量濃度為0.2molL-1
B.根據圖象可以確定導電率與離子種類有關
C.cd段發生的反應是Al(OH)3+OH-=AlO2-+2H2O
D.e點時溶液中的離子濃度:c(K+) =c(Cl-) +c(AlO2-)
【答案】D
【解析】
根據圖象得出I為氨水滴加到氯化鋁溶液中的圖象,II為KOH滴加到氯化鋁溶液中的圖象,c點為恰好反應生成氫氧化鋁沉淀的點。
A選項,根據分析得到c點恰好反應完生成氫氧化鋁沉淀,氫氧化鉀的物質的量是氯化鋁物質的量的3倍,因此AlCl3溶液的物質的量濃度為 ,故A正確;
,故A正確;
B選項,根據圖象可以確定導電率與離子種類、離子濃度有關,故B正確;
C選項,c點是氫氧化鋁沉淀,再加入KOH,則沉淀開始溶解,其cd段發生的反應是Al(OH)3+OH-=AlO2-+2H2O,故C正確;
D選項,e點是KOH、KAlO2、KCl,溶液中的離子濃度:c(K+)+c(H+)=c(Cl-)+c(OH-)+c(AlO2-),故D錯誤。
綜上所述,答案為D。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化學 來源: 題型:
【題目】科學家經過研究發現,CO2 與 H2 在催化劑作用下可轉化成 CH3OH 燃料,是一種減排、環保的有效方法。該可 逆反應發生過程中的能量變化如圖所示,下列說法錯誤的是

A.CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g)為吸熱反應
CO2(g)+3H2(g)為吸熱反應
B.使用催化劑 x 時,正反應的活化能 = △H + 逆反應活化能
C.其他條件一定,與其他催化劑相比,使用催化劑 z 時,反應物 轉化率可能更高
D.從圖中可知,選用不同的催化劑,反應的△H也不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物Z常用于治療心律失常,Z可由有機物X和Y在一定條件下反應制得,下列敘述正確的是
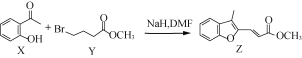
A.X中所有原子可能在同一平面內
B.X、Z均能與酸性KMnO4溶液反應
C.1 mol Y最多能與2 mol NaOH反應
D.室溫下Z與足量Br2加成產物的分子中有2個手性碳原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水電離出的c水(OH-) 的負對數[一lgc水(OH-)]即pOH水-與所加NaOH溶液體積的關系如圖所示。下列說法中正確的是

A.水的電離程度:M>PB.圖中P點至Q點對應溶液中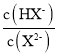 逐漸增大
逐漸增大
C.N點和Q點溶液的pH相同D.P點溶液中![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2和NaClO2均具有漂白性,工業上用ClO2氣體制NaClO2的工藝流程如圖所示。
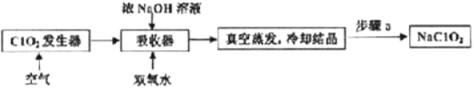
下列說法不正確的是
A.步驟a的操作包括過濾、洗滌和干燥
B.吸收器中生成NaClO2的離子方程式為2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工業上將ClO2氣體制成NaCIO2固體,其主要目的是便于貯存和運輸
D.通入的空氣的目的是驅趕出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列分子中,各分子的空間構型、中心原子的雜化方式以及孤電子對數均正確的是
選項 | 分子 | 空間構型 | 雜化方式 | 孤電子對數 |
A | NH3 | 平面三角形 | sp3雜化 | N含有一對孤電子對 |
B | CCl4 | 正四面體 | sp3雜化 | C不含有孤電子對 |
C | H2O | V形 | sp2雜化 | O含有兩對孤電子對 |
D | CO32- | 三角錐形 | sp3雜化 | C含有一對孤電子對 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:H2(g)+F2(g)=2HF(g) △H1=-270kJmol-1。下列說法不正確的是( )
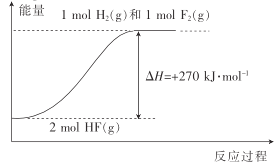
A.1molH2(g)與1molF2(g)的鍵能之和比2molHF(g)的鍵能高270kJ·mol-1
B.HF(g)分解為H2(g)與F2(g)的反應過程的能量變化可用如圖來表示
C.若反應中有20gHF(g)生成,則放出135kJ熱量
D.若H2(g)+Cl2(g)=2HCl(g) △H2=-QkJ·mol-1,則Q<270
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物結構簡式如圖,下列對該物質的敘述中正確的是

A.該有機物能發生取代反應、氧化反應和消去反應
B.1mol該有機物最多可與2molNaOH發生反應
C.該有機物可以與溴的四氯化碳溶液發生加成反應使之褪色
D.該有機物有3個手性碳原子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com