
【題目】pC類似于pH,是指極稀溶液中溶質濃度的負對數。常溫下向H2CO3溶液中逐滴滴加NaOH溶液,測得溶液的pC與pH關系如圖所示。下列說法錯誤的是( )
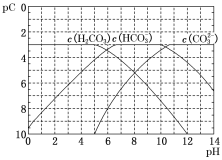
A.在同一溶液中,H2CO3、HCO3–、CO32–不能大量共存
B.H2CO3二級電離平衡常數Ka2的數量級等于10–11
C.當pH=7時,溶液中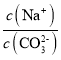 >3
>3
D.向H2CO3溶液滴加NaOH溶液至溶液呈中性的過程中,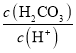 逐漸變小
逐漸變小
【答案】D
【解析】
A.H2CO3存在于酸性較強的溶液中,CO32-存在于堿性較強的溶液中,所以在同一溶液中,H2CO3、HCO3–、CO32–不能大量共存,A項正確;
B.結合H2CO3的二級電離Ka2=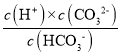 ,由圖像可知,當c(HCO3-)=c(CO32-),Ka2等于此時溶液中的c(H+),由圖像知pH在10~11之間,故H2CO3二級電離平衡常數Ka2的數量級等于10–11,B項正確;
,由圖像可知,當c(HCO3-)=c(CO32-),Ka2等于此時溶液中的c(H+),由圖像知pH在10~11之間,故H2CO3二級電離平衡常數Ka2的數量級等于10–11,B項正確;
C.當pH=7時,根據電荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),可知c(Na+)=c(HCO3-)+2c(CO32-),由圖像可知,當pH=7時,溶液中c(CO32-)<c(HCO3-),所以c(Na+)>3c(CO32-),即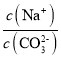 >3,C項正確;
>3,C項正確;
D.H2CO3一級電離平衡常數表達式Ka1=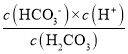 ,向H2CO3溶液滴加NaOH溶液至溶液呈中性的過程中,c(HCO3-)增大,Ka1不變,所以
,向H2CO3溶液滴加NaOH溶液至溶液呈中性的過程中,c(HCO3-)增大,Ka1不變,所以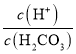 減小,即
減小,即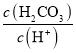 逐漸變大,D項錯誤;
逐漸變大,D項錯誤;
答案選D。


科目:高中化學 來源: 題型:
【題目】0.1 mol的鎂、鋁混合物溶于100 mL 2mol·L-1H2SO4溶液中,然后再滴加1 mol·L-1NaOH溶液。請回答:
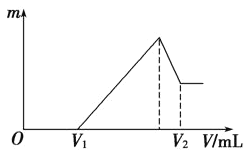
(1)若在滴加NaOH溶液的過程中,沉淀質量m隨加入NaOH溶液的體積V變化如圖所示。當V1=120mL時,則金屬粉末中n(Mg)=________,V2=________mL。
(2)若在滴加NaOH溶液過程中,欲使Mg2+、Al3+剛好沉淀完全,則滴入NaOH溶液的體積V(NaOH)=________mL。
(3)若向300mL 1 mol/LAL2(SO4)3的溶液中逐漸加入濃度為1mol/L的![]() 溶液,若產生2.34克白色沉淀,則加入的NaOH溶液的體積可能為__________毫升。
溶液,若產生2.34克白色沉淀,則加入的NaOH溶液的體積可能為__________毫升。
(4)若混合物仍為0.1 mol,其中Mg粉的物質的量分數為a,用100 mL 2 mol·L-1硫酸溶解此混合物后,再加入460 mL 1 mol·L-1NaOH溶液,所得沉淀中無Al(OH)3。滿足條件的a的取值范圍是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚合硫酸鐵是水處理中重要的絮凝劑。以黃鐵礦的燒渣![]() 主要成分為Fe2O3、FeO、SiO2等
主要成分為Fe2O3、FeO、SiO2等![]() 為原料制取聚合硫酸鐵(Fe2(OH)x(SO4)(3-
為原料制取聚合硫酸鐵(Fe2(OH)x(SO4)(3-![]() ))的工藝流程如圖所示:
))的工藝流程如圖所示:
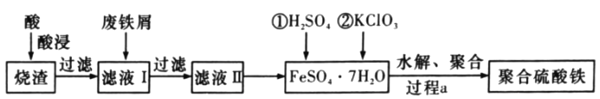
(1)“酸浸”時最合適的酸是______![]() 寫化學式
寫化學式![]() 。
。
(2)“酸浸”后溶液中主要的金屬陽離子有______。
(3)加入KClO3的目的是______(結合離子方程式說明)。
(4)“過程a”中生成聚合硫酸鐵的過程是先水解再聚合,將下列水解反應原理的化學方程式補充完整。Fe2(SO4)3+______H2O![]() ______Fe2(OH)x(SO4)(3-
______Fe2(OH)x(SO4)(3-![]() )+______。
)+______。
(5)鹽基度B是衡量絮凝劑絮凝效果的重要指標,通常鹽基度越高,絮凝效果越好。已知鹽基度B的表達式為B=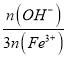 ×100%(n為物質的量
×100%(n為物質的量![]() 。為測出聚合硫酸鐵的鹽基度,進行如下實驗操作:
。為測出聚合硫酸鐵的鹽基度,進行如下實驗操作:
![]() 取聚合硫酸鐵樣品mg,加入過量鹽酸,充分反應,再加入煮沸后冷卻的蒸餾水,再加入KF溶液屏蔽Fe3+,使Fe3+不與OH-反應,然后以酚酞為指示劑,用cmol/L的標準NaOH溶液進行中和滴定,到終點時消耗NaOH溶液V0mL。
取聚合硫酸鐵樣品mg,加入過量鹽酸,充分反應,再加入煮沸后冷卻的蒸餾水,再加入KF溶液屏蔽Fe3+,使Fe3+不與OH-反應,然后以酚酞為指示劑,用cmol/L的標準NaOH溶液進行中和滴定,到終點時消耗NaOH溶液V0mL。
![]() 做空白對比實驗:取與步驟i等體積等濃度的鹽酸,以酚酞為指示劑,用cmol/L的標準NaOH溶液進行中和滴定,到終點時消耗NaOH溶液VmL。
做空白對比實驗:取與步驟i等體積等濃度的鹽酸,以酚酞為指示劑,用cmol/L的標準NaOH溶液進行中和滴定,到終點時消耗NaOH溶液VmL。
①該聚合硫酸鐵樣品中,n(OH-)=______mol。
②已知該樣品中Fe的質量分數為![]() ,則鹽基度B=______。
,則鹽基度B=______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某銅鈷礦石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由該礦石制Co2O3的部分工藝流程如下:
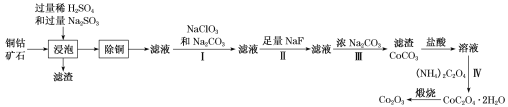
回答下列問題:
(1)“浸泡”過程中,鈷(III)可轉化為CoSO4,寫出該轉化的化學方程式:________。
(2)“除銅”若選用MnS,計算常溫下該“除銅”反應的平衡常數K=________。[保留2位有效數字;已知常溫下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步驟I中加入NaClO3反應的離子方程式為_______。
②常溫下,溶液中金屬離子(Mn+)的pM[pM=–lgc(Mn+)]隨溶液pH變化關系如圖所示,設加入NaClO3后,溶液中的c(CO2+)為0.1molL–1,依據如圖分析,步驟I中加入Na2CO3調整溶液pH范圍為_____。[當c(Mn+)≤10–6 molL–1,即認為該金屬離子沉淀完全]

(4)步驟II中加入足量NaF的目的是________。
(5)過濾出的CoC2O42H2O固體經洗滌后,證明固體已洗凈的操作為________。
(6)若某工廠用m1kg該銅鈷礦石制備了m2kgCo2O3,假設產率為a,則該礦石中鈷元素的百分含量為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】臭氧是理想的煙氣脫硝試劑,其脫硝反應為:2NO2(g)+O3(g) ![]() N2O5(g)+O2(g),若反應在恒容密閉容器中進行,下列由該反應相關圖像作出的判斷正確的是( )
N2O5(g)+O2(g),若反應在恒容密閉容器中進行,下列由該反應相關圖像作出的判斷正確的是( )
A | B | C | D |
|
|
|
|
升高溫度,平衡常數減小 | 0~3 s內,反應速率為:v(NO2)=0.2 mol·L-1 | t1時僅加入催化劑,平衡正向移動 | 達平衡時,僅改變x,則x為c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列敘述正確的是( )
4NO(g)+6H2O(g),下列敘述正確的是( )
A. 化學平衡常數的表達式K=![]()
B. 當v正(NH3)∶v正(NO)=1∶1時,說明該化學反應已經達到平衡狀態
C. 若達到平衡狀態時兩種反應物的轉化率相等,則起始投入時n(NH3)∶n(O2)=5∶4
D. 反應達到平衡狀態后,恒容條件下只調節NH3和NO的量,可保持原平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻的化合物在醫藥、材料領域有重要作用,認識鉻及其化合物有重要意義。
(1)基態鉻原子中,電子占據的最高能級符號為_____________。
(2)研究表明,當化合物的陽離子有未成對電子時,該化合物具有磁性。下列物質可用作錄音帶磁粉的是__________。
A.V2O5 B.Fe2O3 C.ZnO D.CrO2
(3)已知Cr3+在水溶液中的存在形式為[Cr(H2O)6]3+。在不同條件下,可從CrCl3水溶液中獲得紫色、藍綠色或綠色等不同顏色的配合物,其實驗式均為CrCl36H2O。現取藍綠色配合物0.1mol,加入足量AgNO3溶液,經過濾、洗滌、干燥得28.7g沉淀,則該化合物中的化學鍵類型有___________,寫出該藍綠色配合物的電離方程式:________。
(4)常溫下,氯化酰鉻(CrO2Cl2)是暗紅色液體,能與CCl4、CS2等有機溶劑互溶。
①固體氯化酰鉻屬于______(填“極性”或“非極性”)分子,判斷依據是______。
②等電子體是具有相同的價電子數和原子數的分子或離子。寫出一種與CCl4分子互為等電子體的陰離子:_______(填化學式);寫出CS2分子的電子式:____________。
(5)氮化鉻(CrN)在超級電容器領域有良好應用前景,其晶體結構類型與氯化鈉相同。
①氮化鉻的熔點比氯化鈉高的主要原因是______。
②與Cr3+次鄰近的N3–有________個。
③已知Cr3+和N3–半徑分別為apm、bpm,設Cr3+和N3–都是緊密接觸的剛性小球,NA代表阿伏加德羅常數的值,晶體的密度為ρgcm–3,則CrN的摩爾質量為______。(用含a、b、NA、ρ的算式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組向某2 L密閉容器中加入一定量的固體A和氣體B,發生反應A(s)+2B(g)![]() D(g)+E(g) ΔH=Q kJ·mol-1。在T℃時,反應進行到不同時間測得各物質的物質的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T℃時,反應進行到不同時間測得各物質的物質的量如表:
時間(min) 物質的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T℃時,該反應的平衡常數K=________。
(2)30min后,只改變某一條件,反應重新達到平衡,根據表中的數據判斷改變的條件可能是________(填字母編號)。
a.通入一定量的B b.加入一定量的固體A c.適當縮小容器的體積 d.升高反應體系溫度 e.同時加入0.2mol B、0.1mol D、0.1mol E
(3)寫出下列電解質在水中的電離方程式:
CH3COOH:____________NaHSO4:______ NaHCO3:_________H2CO3:_________
查看答案和解析>>
科目:高中化學 來源: 題型:
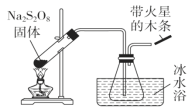
【題目】過硫酸鈉(Na2S2O8)具有極強的氧化性,且不穩定,某化學興趣小組探究過硫酸鈉的相關性質,實驗如下。已知SO3是無色易揮發的固體,熔點16.8℃,沸點44.8℃。
(1)穩定性探究(裝置如圖):
分解原理:2Na2S2O8![]() 2Na2SO4+2SO3↑+O2↑。
2Na2SO4+2SO3↑+O2↑。
此裝置有明顯錯誤之處,請改正:______________________,水槽冰水浴的目的是____________________;帶火星的木條的現象_______________。
(2)過硫酸鈉在酸性環境下,在Ag+的催化作用下可以把Mn2+氧化為紫紅色的離子,所得溶液加入BaCl2可以產生白色沉淀,該反應的離子方程式為______________________,該反應的氧化劑是______________,氧化產物是________。
(3)向上述溶液中加入足量的BaCl2,過濾后對沉淀進行洗滌的操作是___________________________。
(4)可用H2C2O4溶液滴定產生的紫紅色離子,取20mL待測液,消耗0.1mol·L-1的H2C2O4溶液30mL,則上述溶液中紫紅色離子的濃度為______mol·L-1,若Na2S2O8有剩余,則測得的紫紅色離子濃度將________(填“偏高”“偏低”或“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com