
【題目】鉻的化合物在醫藥、材料領域有重要作用,認識鉻及其化合物有重要意義。
(1)基態鉻原子中,電子占據的最高能級符號為_____________。
(2)研究表明,當化合物的陽離子有未成對電子時,該化合物具有磁性。下列物質可用作錄音帶磁粉的是__________。
A.V2O5 B.Fe2O3 C.ZnO D.CrO2
(3)已知Cr3+在水溶液中的存在形式為[Cr(H2O)6]3+。在不同條件下,可從CrCl3水溶液中獲得紫色、藍綠色或綠色等不同顏色的配合物,其實驗式均為CrCl36H2O。現取藍綠色配合物0.1mol,加入足量AgNO3溶液,經過濾、洗滌、干燥得28.7g沉淀,則該化合物中的化學鍵類型有___________,寫出該藍綠色配合物的電離方程式:________。
(4)常溫下,氯化酰鉻(CrO2Cl2)是暗紅色液體,能與CCl4、CS2等有機溶劑互溶。
①固體氯化酰鉻屬于______(填“極性”或“非極性”)分子,判斷依據是______。
②等電子體是具有相同的價電子數和原子數的分子或離子。寫出一種與CCl4分子互為等電子體的陰離子:_______(填化學式);寫出CS2分子的電子式:____________。
(5)氮化鉻(CrN)在超級電容器領域有良好應用前景,其晶體結構類型與氯化鈉相同。
①氮化鉻的熔點比氯化鈉高的主要原因是______。
②與Cr3+次鄰近的N3–有________個。
③已知Cr3+和N3–半徑分別為apm、bpm,設Cr3+和N3–都是緊密接觸的剛性小球,NA代表阿伏加德羅常數的值,晶體的密度為ρgcm–3,則CrN的摩爾質量為______。(用含a、b、NA、ρ的算式表示)
【答案】3d BD 離子鍵、(極性)共價鍵、配位鍵 [Cr(H2O)5C1]C12=[Cr(H2O)5C1]2++2Cl- 非極性 根據相似相溶原理,CC14、CS2為非極性分子,所以CrO2C12為非極性分子 PO43–、SO42–、C1O4– ![]() 氮化鉻中離子所帶電荷數較多,晶格能較大 8
氮化鉻中離子所帶電荷數較多,晶格能較大 8 ![]()
【解析】
(5)③根據題給信息,結合晶胞的質量公式:①m=ρV、②![]() ,可得:
,可得:![]() ,由此可知,要計算CrN的摩爾質量,需計算晶胞的體積、晶胞中所含的微粒個數,據此進行分析求解。
,由此可知,要計算CrN的摩爾質量,需計算晶胞的體積、晶胞中所含的微粒個數,據此進行分析求解。
(1)Cr元素的基態原子的電子排布式為[Ar]3d54s1,3d能級與4s能級存在能級交錯,3d能量高于4s的,所以基態鉻原子中電子占據的最高能級符號為3d,答案為:3d;
(2)由信息知:化合物具有磁性需要滿足陽離子有未成對電子,據此
A.V2O5中釩為+5價,對應陽離子的電子排布式為1s22s22p63s23p6,陽離子中沒有未成對電子,所以V2O5沒有磁性,A項錯誤;
B.Fe2O3中鐵為+3價,對應陽離子的電子排布式為1s22s22p63s23p63d5,3d5有5個未成對電子,所以Fe2O3有磁性,B項正確;
C.ZnO中鋅為+2價,對應陽離子的電子排布式為1s22s22p63s23p63d10,陽離子中沒有未成對電子,所以ZnO沒有磁性,C項錯誤;
D.CrO2中鉻為+4價,對應陽離子的電子排布式為1s22s22p63s23p63d2,3d2有2個未成對電子,所以CrO2有磁性,D項正確;
答案為:BD;
(3)向0.1mol藍綠色配合物中加入足量的AgNO3溶液,經過濾、洗滌、干燥得28.7g沉淀,即n(AgCl)=![]() ,故1mol藍綠色配合物中加入足量的AgNO3能產生2molAgCl沉淀,因為配合物內界不電離出離子,而1mol藍綠色配合物中有3molCl-,所以藍綠色配合物外界的Cl-是內界的2倍,即外界2份Cl-,內界1份Cl-;再根據“已知Cr3+在水溶液中的存在形式為[Cr(H2O)6]3+”可知Cr的配位數為6,所以內界還有5份H2O,外界還有1份H2O,因此藍綠色配合物的結構式為[Cr(H2O)5C1]C12·H2O;由于配合物由內界和外界,能電離出離子,所以含有離子鍵,H2O中存在(極性)共價鍵,內界的H2O、Cl-與Cr3+之間存在配位鍵,其電離方程式為:[Cr(H2O)5C1]C12=[Cr(H2O)5C1]2++2Cl-。答案為:離子鍵、(極性)共價鍵、配位鍵;[Cr(H2O)5C1]C12=[Cr(H2O)5C1]2++2Cl-;
,故1mol藍綠色配合物中加入足量的AgNO3能產生2molAgCl沉淀,因為配合物內界不電離出離子,而1mol藍綠色配合物中有3molCl-,所以藍綠色配合物外界的Cl-是內界的2倍,即外界2份Cl-,內界1份Cl-;再根據“已知Cr3+在水溶液中的存在形式為[Cr(H2O)6]3+”可知Cr的配位數為6,所以內界還有5份H2O,外界還有1份H2O,因此藍綠色配合物的結構式為[Cr(H2O)5C1]C12·H2O;由于配合物由內界和外界,能電離出離子,所以含有離子鍵,H2O中存在(極性)共價鍵,內界的H2O、Cl-與Cr3+之間存在配位鍵,其電離方程式為:[Cr(H2O)5C1]C12=[Cr(H2O)5C1]2++2Cl-。答案為:離子鍵、(極性)共價鍵、配位鍵;[Cr(H2O)5C1]C12=[Cr(H2O)5C1]2++2Cl-;
(4)①根據相似相溶原理,CCl4、CS2為非極性分子,所以CrO2Cl2為非極性分子;答案為:非極性;根據相似相溶原理,CCl4、CS2為非極性分子,所以CrO2Cl2為非極性分子;
②等電子體是具有相同的價電子數和原子數的分子或離子,CCl4具有AX4通式,CCl4含有5個原子、32個價電子,和PO43-、SO42-、ClO4-這些離子互為等電子體;CS2的電子式為:![]() span>;答案為:PO43–、SO42–、C1O4–;
span>;答案為:PO43–、SO42–、C1O4–;![]() ;
;
(5)①通常離子所帶電荷數越多,晶格能就越大,熔沸點就越高。答案為:氮化鉻中離子所帶電荷數較多,晶格能較大;
②由題給信息:氮化鉻晶體結構類型與氯化鈉相同,據此分析,頂點的Cr3+到體心N3-的距離為次鄰近距離,該頂點的Cr3+為8個晶胞所共有,所以與該頂點的Cr3+次鄰近的N3-是8個。答案為:8;
③已知Cr3+和N3-半徑分別為apm、bpm,Cr3+和N3-都是緊密接觸的剛性小球,所以晶胞的邊長為(2a+2b)pm=![]() 。由于Cr3+位于8個頂點和6個面的面心上,所以一個晶胞中有4個Cr3+;N3-位于12條棱上和1個體心,所以一個晶胞中有4個N3-,即一個晶胞中有4個CrN,一個晶胞的質量即4個CrN的質量,設CrN的摩爾質量為M,則一個晶胞的質量m=
。由于Cr3+位于8個頂點和6個面的面心上,所以一個晶胞中有4個Cr3+;N3-位于12條棱上和1個體心,所以一個晶胞中有4個N3-,即一個晶胞中有4個CrN,一個晶胞的質量即4個CrN的質量,設CrN的摩爾質量為M,則一個晶胞的質量m=![]() 。而晶胞質量還等于晶胞密度與晶胞體積的乘積,即
。而晶胞質量還等于晶胞密度與晶胞體積的乘積,即![]() ,晶胞的體積V=
,晶胞的體積V=![]() ,所以晶胞質量的關系式如下:
,所以晶胞質量的關系式如下:![]() ,整理得M=
,整理得M=![]() 。答案為:
。答案為: ![]() 。
。


科目:高中化學 來源: 題型:
【題目】探究氨氣及銨鹽性質的過程中,下列根據實驗現象得出的結論不正確的是( )
A. 將集有氨氣的試管倒扣于水槽中,液體迅速充滿試管,說明氨氣極易溶于水
B. 將pH=11的氨水稀釋1000倍,測得pH>8,說明NH3·H2O為弱堿
C. 加熱NH4HCO3固體,觀察到固體逐漸減少,試管口有液滴產生,說明NH4HCO3受熱不穩定
D. 將紅熱的Pt絲伸入右圖所示的錐形瓶中,瓶口出現少量紅棕色氣體,說明氨氣的氧化產物為NO2
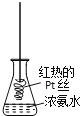
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X、Y、Z、Q、E五種元素的原子序數依次增大,其中X原子核外電子有6種不同的運動狀態,s能級電子數是p能級電子數的兩倍;Z原子L層上有2對成對電子;Q是第三周期中電負性最大的元素;E的單質是常溫下唯一呈液態的非金屬。請回答下列問題:
(1)X、Y、Z第一電離能由小到大的順序為__________(填元素符號)。Y的氫化物的分子空間構型是_______。其中心原子采取_____雜化,屬__________(填“極性”或“非極性”)分子。
(2)E元素基態原子的電子排布式為_______________________________。
(3)XZ2分子中含有________個π鍵。
(4)Z氫化物的沸點比Q氫化物的沸點高,理由是____________________________。
(5)X元素可形成X60單質,它與金屬鉀摻雜在一起制造了一種富勒烯化合物,其晶胞如圖所示(白球位于立方體的體心和頂點,小黑球位于立方體的面上),該化合物中X60與鉀原子個數比為___________。
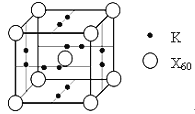
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】pC類似于pH,是指極稀溶液中溶質濃度的負對數。常溫下向H2CO3溶液中逐滴滴加NaOH溶液,測得溶液的pC與pH關系如圖所示。下列說法錯誤的是( )
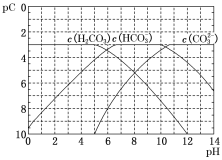
A.在同一溶液中,H2CO3、HCO3–、CO32–不能大量共存
B.H2CO3二級電離平衡常數Ka2的數量級等于10–11
C.當pH=7時,溶液中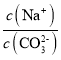 >3
>3
D.向H2CO3溶液滴加NaOH溶液至溶液呈中性的過程中,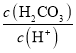 逐漸變小
逐漸變小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W為原子序數依次增大的短周期主族元素,它們形成的某種化合物陰離子結構如圖。其中X、Z為同主族元素,Y最外層電子數是內層的3倍,W最外層電子數為核外電子總數的![]() ,下列說法正確的是()
,下列說法正確的是()

A.簡單氫化物穩定性:W>Y
B.ZX與X2Y反應,ZX做還原劑,1molZX轉移電子數為2NA
C.X2WY2–具有還原性
D.X、Z分別與Y形成的二元化合物中含有的化學鍵類型完全不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】300 ℃時,將2 mol A和2 mol B兩種氣體混合于2 L密閉容器中,發生如下反應:3A(g)+B(g)![]() 2 C(g)+2D(g) ΔH=Q, 2 min末達到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末達到平衡,生成0.8 mol D。
(1)300℃時,該反應的平衡常數表達式為K=______________,已知K300℃<K350℃,則ΔH____0(填“>”或“<”)。
(2)在2 min末時,B的平衡濃度為________,D的平均反應速率為________。
(3)若溫度不變,縮小容器容積,則A的轉化率________(填“增大”“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下進行下列實驗,根據實驗操作和現象所得到的結論正確的是
選項 | 實驗操作和現象 | 結論 |
A | 向X溶液中滴加 | X溶液中一定含有 |
B | 向濃度均為0.05mol·L-1的 |
|
C | 向2mL濃度均為0.05mol·L-1的 |
|
D | 向 | 結合 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 反應過程的能量變化如圖所示,請回答下列問題:
反應過程的能量變化如圖所示,請回答下列問題:
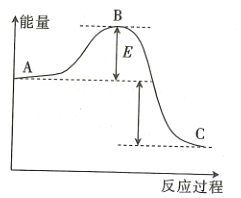
(1)該反應是______________(填“放熱”或“吸熱”)反應。
(2)用![]() 作該反應的催化劑,A、C兩點的能量差是否變化?_____________(填“變化”或“不變”),理由是____________________。
作該反應的催化劑,A、C兩點的能量差是否變化?_____________(填“變化”或“不變”),理由是____________________。
(3)在體積為2L的恒容密閉容器中通入2mol![]() 和3mol
和3mol![]() 發生上述反應,10min內
發生上述反應,10min內![]() 的物質的量變化如下表:
的物質的量變化如下表:
反應時間(min) | 0 | 3 | 5 | 7 | 10 |
| 0 | 0.2 | 0.3 | 0.38 | 0.38 |
①升高溫度,反應速率______________(填“增大”或“減小”)。
②上述反應在7min時_______________(填“達到”或“未達到”)平衡狀態。
③![]() min內,用
min內,用![]() 表示該反應的反應速率為_______________mol·L-1·min-1。
表示該反應的反應速率為_______________mol·L-1·min-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加羅常數的值,下列說法正確的是( )
A.標準狀況下,22.4 L H2O中含有氫原子數目為2NA
B.17 g NH3所含質子數為10NA
C.0.1 mol Cu(NO3)2中含有的離子數目為0.2NA
D.28 g N2體積為22.4L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com